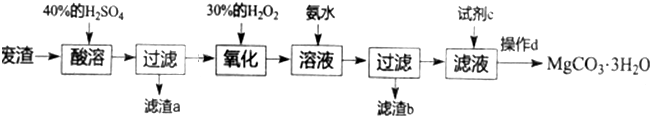
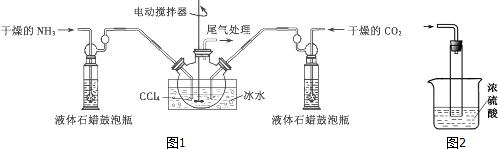
题目内容
14.把 3mol A和2.5mol B 混合于 2L 的密闭容器中,使它们发生反应:3A(气)+B(气)?xC(气)+2D(气)经5min后达到平衡生成1mol D,并测定C的平均速率为0.1mol/(L•min),则此反应中的B的转化率为20%,C的系数为2,A的平衡浓度为0.75mol/L.
分析 经5min后达到平衡生成1mol D,v(D)=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L•min),并测定C的平均速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知,x=2,则
3A(气)+B(气)?2C(气)+2D(气)
开始 3 2.5 0 0
转化 1.5 0.5 1 1
平衡 1.5 2 1 1
结合c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:经5min后达到平衡生成1mol D,v(D)=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L•min),并测定C的平均速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知,x=2,则
3A(气)+B(气)?2C(气)+2D(气)
开始 3 2.5 0 0
转化 1.5 0.5 1 1
平衡 1.5 2 1 1
则此反应中的B的转化率为$\frac{0.5mol}{2.5mol}$×100%=20%,C的系数为2,A的平衡浓度为$\frac{1.5mol}{2L}$=0.75mol/L,
故答案为:20%;2;0.75mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算为解答的关键,侧重分析与计算能力的考查,注意x的确定方法,题目难度不大.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
| A. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 | |
| B. | 在pH<5的溶液中,金属主要发生析氢腐蚀 | |
| C. | 钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- | |
| D. | 在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
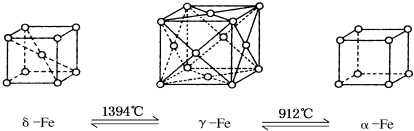
| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
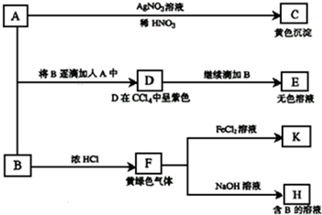
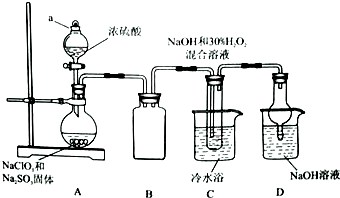 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.