题目内容
7.表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )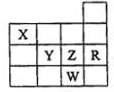
| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
分析 由元素在周期表的位置可知,X为N,Y为S,Z为Cl,R为Ar,W为Br,
A.常压下,只有S的单质为固体;
B.阴离子的电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
C.非金属性越强,对应氢化物的还原性越弱;
D.Z元素的最高价氧化物的水化物为HClO4.
解答 解:由元素在周期表的位置可知,X为N,Y为S,Z为Cl,R为Ar,W为Br,
A.常压下,只有S的单质为固体,则五种元素的单质中Y单质的沸点最高,故A错误;
B.阴离子的电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则Z、Y、W的阴离子半径依次增大,故B错误;
C.非金属性越强,对应氢化物的还原性越弱,则X的氢化物比同族元素的氢化物还原性弱,故C错误;
D.Z元素的最高价氧化物的水化物为HClO4,为所有含氧酸中酸性最强的酸,故D正确;
故选D.
点评 本题考查位置、结构及性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意周期表的结构及应用,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6.X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同族,Y是短周期主族元素中原子半径最大的,X是农作物生长的三种必须营养元素之一,W的单质以前常用于自来水消毒.下列说法正确的是( )
| A. | Z的最高价氧化物的水化物能形成多种含Y元素的盐 | |
| B. | W的氧化物对应水化物的酸性一定强于Z | |
| C. | Y的一种氧化物中含有离子键和极性共价键 | |
| D. | X的氢化物沸点比Z的氢化物沸点低 |
2.1mol乙烯和氯气发生加成反应生成氯乙烷,该氯乙烷继续和Cl2发生取代反应,最多可再消耗Cl2的物质的量为( )
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
12.草酸广泛分布于植物、动物体中,并在不同的生命体中发挥不同的功能.草酸还是一种重要的工业原料,在工农业生产中具有广泛的用途.回答下列问题:
(1)草酸是一种常见的有机化合物,结构简式为HOOC-COOH,其中碳元素的化合价为+3,草酸官能团的名称是羧基.
(2)已知草酸、碳酸的各级电离常数如表:
写出草酸溶液与少量碳酸钠固体反应的化学方程式:2H2C2O4+Na2CO3=2NaHC2O4+CO2↑+H2O.
(3)人和动物摄入草酸过多,可能会导致结石.结石的主要成分是难解的草酸钙,草酸钙的溶度积常数表达式Ksp=c(Ca2+).c(C2O42-),.乙二胺四乙酸(也称“EDTA”)是一种能结合二价金属离子的试剂,因此该试剂能有效溶解结石,其溶解原理是草酸钙在人体体液中存在溶解平衡,即CaCrO4(s)?Ca2+(aq)+CrO42-(aq),乙二胺四乙酸(EDTA)结合Ca2+生成可溶性物质,平衡正向移动,结石逐渐溶解.
(4)将0.2mol/L的NaOH溶液缓缓地滴入10mL0.1mol/L的草酸溶液中,当滴入NaOH溶液的体积为7.5mL时,测得溶液为酸性,则HCO4-的电离程度大于C2O2的水解程度(填“大于”“等于”或“小于”);当滴入NaOH溶液的体积为10mL时,c(HC2O4-)+2c(C2O42-)<c(Na+)(填“>”“=”或“<”).
(5)草酸结晶水合物(H2C2O4•2H2O) 的纯度可用KMnO4溶液测定(杂质不与KMnO4反应).步骤是:
①称取0 500g草酸晶体样品,配制成100mL水溶液.该操作过程中选取的玻璃仪器有玻瑞棒、烧杯、量筒、100mL容量瓶、胶头滴管.
②用滴定管量取配制好的草酸溶液20.00mL于锥形瓶中,然后用浓度为0.200mol/L的酸性KMnO4溶液滴定,直至溶液呈浅粉红色,且半分钟内不褪色,实验过程中消耗14.80ml KMnO4溶液,则草酸晶体的纯度为(结果保留3位有效数字).
(1)草酸是一种常见的有机化合物,结构简式为HOOC-COOH,其中碳元素的化合价为+3,草酸官能团的名称是羧基.
(2)已知草酸、碳酸的各级电离常数如表:
| 草酸 | 碳酸 | |
| 一级电离常数(Kad) | 5.9×10-2 | 4.2×10-7 |
| 二级电离常数(Kad) | 6.4×10-3 | 5.6×10-11 |
(3)人和动物摄入草酸过多,可能会导致结石.结石的主要成分是难解的草酸钙,草酸钙的溶度积常数表达式Ksp=c(Ca2+).c(C2O42-),.乙二胺四乙酸(也称“EDTA”)是一种能结合二价金属离子的试剂,因此该试剂能有效溶解结石,其溶解原理是草酸钙在人体体液中存在溶解平衡,即CaCrO4(s)?Ca2+(aq)+CrO42-(aq),乙二胺四乙酸(EDTA)结合Ca2+生成可溶性物质,平衡正向移动,结石逐渐溶解.
(4)将0.2mol/L的NaOH溶液缓缓地滴入10mL0.1mol/L的草酸溶液中,当滴入NaOH溶液的体积为7.5mL时,测得溶液为酸性,则HCO4-的电离程度大于C2O2的水解程度(填“大于”“等于”或“小于”);当滴入NaOH溶液的体积为10mL时,c(HC2O4-)+2c(C2O42-)<c(Na+)(填“>”“=”或“<”).
(5)草酸结晶水合物(H2C2O4•2H2O) 的纯度可用KMnO4溶液测定(杂质不与KMnO4反应).步骤是:
①称取0 500g草酸晶体样品,配制成100mL水溶液.该操作过程中选取的玻璃仪器有玻瑞棒、烧杯、量筒、100mL容量瓶、胶头滴管.
②用滴定管量取配制好的草酸溶液20.00mL于锥形瓶中,然后用浓度为0.200mol/L的酸性KMnO4溶液滴定,直至溶液呈浅粉红色,且半分钟内不褪色,实验过程中消耗14.80ml KMnO4溶液,则草酸晶体的纯度为(结果保留3位有效数字).
 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷.

 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.