题目内容
11.相同温度下,根据三种酸的电离常数,下列判断正确的是( )| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
分析 相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,结合强酸制取弱酸分析解答.
解答 解:A.相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,这三种酸的强弱顺序是HR>HN>HM,故A错误;
B.由A知,HR的酸性大于HN,根据强酸制取弱酸知,HR+N-═HN+R-能发生,故B正确;
C.由A知三种酸的强弱顺序是HR>HN>HM,所以相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液的酸性最弱,pH 最大,故C正确;
D.电离平衡常数是温度的函数,相同温度下,同一物质的电离平衡常数不变,故D错误;
故选BC.
点评 本题考查了弱电解质的电离,明确相同温度下电离平衡常数与电解质强弱的关系是解本题关键,易错选项是D,注意温度不变,同一物质的电离平衡常数不变,与溶液的浓度无关,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.1mol乙烯和氯气发生加成反应生成氯乙烷,该氯乙烷继续和Cl2发生取代反应,最多可再消耗Cl2的物质的量为( )
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
6.一定条件下,有关金属腐蚀的下列说法不正确的是( )
| A. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 | |
| B. | 在pH<5的溶液中,金属主要发生析氢腐蚀 | |
| C. | 钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- | |
| D. | 在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
3.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化.下列说法不正确的是( )
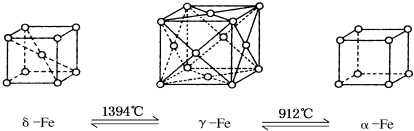

| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
20.已知:
Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s);△H=234.1KJ/mol
C(s)+O2(g)═CO2(g);△H=-393.5KJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的△H是( )
| A. | -1648.8KJ/mol | B. | -824.4KJ/mol | C. | +1648.8KJ/mol | D. | -744.7KJ/mol |
1.下列说法正确的是( )
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2SiO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 因为NH3•H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |