题目内容
13.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )| A. | 第一块钠消耗的氧气多 | B. | 两块钠消耗的氧气一样多 | ||
| C. | 第二块钠的反应产物质量大 | D. | 两块钠的反应产物质量一样大 |
分析 钠在足量氧气中加热时发生反应为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,在足量氧气(常温)中充分反应为:4Na+O2=2Na2O,根据反应方程式判断钠足量相等时耗氧量及产物足量.
解答 解:A.等质量的钠具有相同的物质的量,根据反应①2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2、②4Na+O2=2Na2O可知,反应①耗氧量大于反应②,故A正确;
B.根据A可知,两块钠消耗的氧气量不相等,故B错误;
C.根据4Na+O2=2Na2O,则1mol金属钠获得氧化钠的质量是31g,根据反应2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,则1mol金属钠获得过氧化钠的质量是39g,等质量的两块钠,即金属钠的物质的量是相等的,所以生成过氧化钠的质量大,即第一块钠的反应产物质量最大,故C错误;
D.根据C的计算可知,两块钠的反应产物质量不相等,故D错误;
故选A.
点评 本题考查了化学方程式的计算、金属钠的化学性质,题目难度不大,明确发生反应的实质为解答关键,注意掌握金属钠的化学性质,试题有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )| A. | 阴离子的半径从大到小排列顺序为:X>Y>Z>W | |
| B. | X、Y、Z、W元素的氢化物分子间都可以形成氢键 | |
| C. | Y的两种同素异形体在常温下可以相互转化 | |
| D. | 最高价氧化物对应的水化物的酸性:W>Z |
8.化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是( )

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
18.下列离子方程式书写正确的是( )
| A. | 过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| B. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O | |
| C. | Fe2(SO4)3的酸性溶液中通入足量硫化氢Fe3++H2S=Fe2++S↓+2H+ | |
| D. | 在碳酸氢钙溶液中加入过量氢氧化钠溶液Ca2++HCO3-+OH-=CaCO3↓+H2O |
5.下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是( )
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
3.下列化合物中,既含有离子键,又含有非极性共价键的是( )
| A. | H2O2 | B. | NaOH | C. | Na2O2 | D. | NH4Cl |
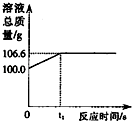 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答: