题目内容
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1mol?L-1 Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:
②设计实验方案:在不同H2O2浓度下,测定 (要求所测得的数据能直接体现反应速率大小).
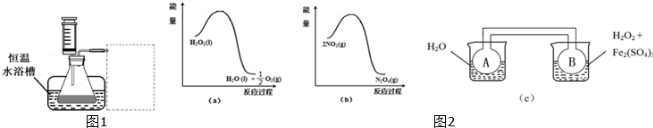
③设计实验装置,完成如1图所示的装置示意图.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
(2)利用图2(a)和2(b)中的信息,按图2(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 .
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1mol?L-1 Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:
②设计实验方案:在不同H2O2浓度下,测定
③设计实验装置,完成如1图所示的装置示意图.

④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 实验序号 物理量 | V[0.1mol?L-1 Fe2(SO4)3]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
考点:真题集萃,测定某些化学反应的速率,探究温度、压强对化学反应速率的影响,性质实验方案的设计
专题:实验设计题
分析:(1)①过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气,反应中过氧化氢既作氧化剂又做还原剂;
②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;
④测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入双氧水溶液体积与水的总体积不变,通过改变二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接;
④测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入双氧水溶液体积与水的总体积不变,通过改变二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
解答:
解:(1)①过氧化氢在硫酸铁作催化剂条件下分解生成水与氧气,反应中过氧化氢既作氧化剂又做还原剂,标出电子转移数目及方向为: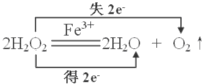 ,
,
故答案为: ;
;
②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少,
故答案为:相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为: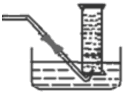 ,
,
故答案为: ;
;
④测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入双氧水溶液体积与水的总体积不变,通过改变二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响,实验方案为:
故答案为:
;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
 ,
,故答案为:
 ;
;②反应速率表示单位时间内物质的量浓度变化量,测定不同浓度的过氧化氢对反应速率的影响,需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少,
故答案为:相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;
③利用排水量气法收集一定体积的氧气,用盛满水的量筒倒立于盛水的水槽中,并用导管与图1连接,装置图为:
 ,
,故答案为:
 ;
;④测定相同时间内产生氧气的体积多少,保证催化剂的浓度应相同,故加入双氧水溶液体积与水的总体积不变,通过改变二者体积,根据相同时间内生成氧气的体积说明不同H2O2浓度对反应速率影响,实验方案为:
| 实验序号 | V[0.1mol?L-1 Fe2(SO4)3]/mL | V(30% H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | a | b | c | d | m |
| 2 | a | c | b | d | n |
| 实验序号 | V[0.1mol?L-1 Fe2(SO4)3]/mL | V(30% H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | a | b | c | d | m |
| 2 | a | c | b | d | n |
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
点评:本题考查氧化还原反应、反应速率影响因素实验、化学平衡移动等,侧重对学生综合能力的考查,需要学生具备扎实的基础,注意利用控制变量法测定外界条件对反应速率的影响,难度中等.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
下列实验操作或装置符合实验要求的是( )


| A、装置Ⅰ可用于测定中和热 |
| B、装置Ⅱ装置放置一段时间后,饱和CuSO4溶液中不出现蓝色晶体 |
| C、装置Ⅲ中的石英坩埚可用于熔化氢氧化钠 |
| D、装置Ⅳ可用于吸收易溶于水的尾气 |
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、84g NaHCO3晶体中含有NA个CO32- |
| B、0.1mol?L-1K2CO3溶液中,阴离子总数大于0.1NA |
| C、1.8g石墨和C60的混合物中,碳原子数目为0.15NA |
| D、标准状况下,22.4L CCl4中含有的共用电子对数目为4NA |
下列有关离子方程式正确的是( )
| A、向稀盐酸中加入少量钠粒:2Na+2H2O═2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓ |
| C、用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O═Al(OH)3↓+Mg2+ |
下列离子方程式正确的是( )
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
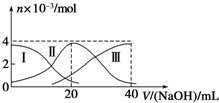 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 |
| C、NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |

 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示: