题目内容
 在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内M、N两种物质随时间变化的曲线如图所示:(1)由图中的数据分析,该反应的化学方程式为
(2)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
(3)t3 min末N的正反应速率与 t3min后N的正反应速率相比
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)随反应进行反应物的物质的量减小,生成物的物质的量增大.反应结束反应物的物质的量为定值,反应为可逆反应,根据物质的量之比等于化学计量数之比,书写方程式;
(2)根据v=
计算以M表示的平均反应速率;
(3)根据浓度的变化判断反应所状态再据此判断反应速率;
(2)根据v=
| △c |
| △t |
(3)根据浓度的变化判断反应所状态再据此判断反应速率;
解答:
解:(1)由图可知随反应进行N的物质的量变小,M的物质的量变大,所以N为反应物,M为生成物,反应结束各物质的物质的量不变,所以反应为可逆反应,N、M的化学计量数之比为(8-2)mol:(5-2)mol:0.2mol=2:1,所以反应方程式为2N M,故答案为:2N
M,故答案为:2N M;
M;
(2)由图可知2min内M的物质的量变化量为2mol,所以2min内以M表示的平均反应速率v(M)=
=0.25mol/(L?min),故答案为:0.25mol/(L?min);
(3)由图可知t3 min末与 t3min后N的物质的量始终没有发生变化,也就是说反应已经处于平衡状态,所以t3 min末N的正反应速率与 t3min后N的正反应速率相等,故答案为:相等.
 M,故答案为:2N
M,故答案为:2N M;
M;(2)由图可知2min内M的物质的量变化量为2mol,所以2min内以M表示的平均反应速率v(M)=
| ||
| 2min |
(3)由图可知t3 min末与 t3min后N的物质的量始终没有发生变化,也就是说反应已经处于平衡状态,所以t3 min末N的正反应速率与 t3min后N的正反应速率相等,故答案为:相等.
点评:本题主要考查了根据图象写方程式和反应速率的计算及反应速率的判断,比较容易解决,关键是看清图象.

练习册系列答案
相关题目
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A、上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B、CO2是氧化产物,且为H2CO3的酸酐 |
| C、等质量的N2O和CO2含有相等的电子数 |
| D、N2O会迅速与人体血红蛋白结合,使人中毒 |
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图所示:
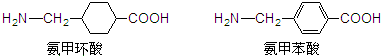
下列说法错误的是( )
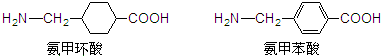
下列说法错误的是( )
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
松萝酸常作为牙膏和化妆品的添加剂,可由三羟基苯乙酮两步反应得到,有关说法正确的是( )
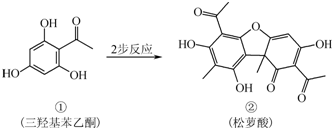

| A、有机物①的分子式为C8H8O4 |
| B、有机物②中含有1个手性碳原子 |
| C、检验②中是否含有杂质①,可用FeCl3溶液 |
| D、相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
葡萄糖在人体中进行无氧呼吸产生乳酸,结构简式如下: ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )
 ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )| A、乳酸能发生催化氧化、取代反应 |
| B、乳酸和葡萄糖所含官能团相同 |
| C、乳酸能和碳酸氢钠、钠反应放出气体 |
D、乳酸和 互为同分异构体 互为同分异构体 |
结合如图装置判断,下列叙述正确的是( )
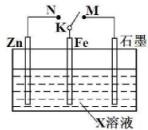

| A、若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-═Cl2↑ |
| B、若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C、若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D、若X为NaCl,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
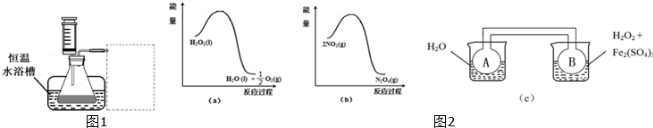
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.