题目内容
下列离子方程式正确的是( )
| A、将少量SO2气体通入NaClO溶液中SO2+2ClO-+H2O═SO32-+2HClO |
| B、苯酚钠溶液中通入少量的二氧化碳气体C6H5O-+CO2+H2O═C6H5OH+HCO3- |
| C、足量的溴化亚铁溶液和少量的氯气反应2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向氯化铝溶液中加入过量的氨水Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应产物错误,次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
B.苯酚酸性强于碳酸氢根离子,苯酚钠与二氧化碳反应生成苯酚和碳酸氢根离子;
C.氯气少量,亚铁离子还原性强于溴离子,只有亚铁离子被氧化;
D.一水合氨为弱碱,不会溶解氢氧化铝沉淀,二者反应生成氢氧化铝沉淀.
B.苯酚酸性强于碳酸氢根离子,苯酚钠与二氧化碳反应生成苯酚和碳酸氢根离子;
C.氯气少量,亚铁离子还原性强于溴离子,只有亚铁离子被氧化;
D.一水合氨为弱碱,不会溶解氢氧化铝沉淀,二者反应生成氢氧化铝沉淀.
解答:
解:A.将少量SO2气体通入NaClO溶液中,反应生成的是硫酸根离子,正确的离子方程式为:SO2+ClO-+H2O═2H++SO42-+Cl-,故A错误;
B.苯酚钠溶液中通入少量的二氧化碳气体,反应生成苯酚和碳酸氢根离子,反应的离子方程式为:C6H5O-+CO2+H2O═C6H5OH+HCO3-,故B正确;
C.足量的溴化亚铁溶液和少量的氯气反应,亚铁离子优先被氯气氧化,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.氯化铝与氨水反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
B.苯酚钠溶液中通入少量的二氧化碳气体,反应生成苯酚和碳酸氢根离子,反应的离子方程式为:C6H5O-+CO2+H2O═C6H5OH+HCO3-,故B正确;
C.足量的溴化亚铁溶液和少量的氯气反应,亚铁离子优先被氯气氧化,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.氯化铝与氨水反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对下列与化学有关的社会和生活问题作出判断,其中正确的是( )
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、大型制冷设备的液氨大量泄漏不会对操作人员造成伤害 |
| C、Al(SO4)3可用于对自来水进行杀菌消毒 |
| D、静电除尘与胶体的基本性质有一定联系 |
下表是常温下的五种溶液,下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A、表中五种溶液.其中①~④由水电离出的c(H+):②=④>①=③ |
| B、在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+) |
| C、分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
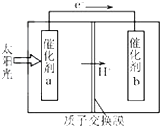 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、该过程是将太阳能转化为化学能的过程 |
| D、催化剂b表面的反应是CO2+2H++2e-═HCOOH |
 利用人工光合作用合成甲酸的原理为2CO2+2H2O
利用人工光合作用合成甲酸的原理为2CO2+2H2O| 太阳能 |
| 光触媒 |
| A、该装置将太阳能转化为化学能和电能 |
| B、电极1周围pH增大 |
| C、电极2上发生的反应为:CO2+2H++2e-═HCOOH |
| D、H+由电极1室经过质子膜流向电极2室 |