题目内容
下列有关离子方程式正确的是( )
| A、向稀盐酸中加入少量钠粒:2Na+2H2O═2Na++2OH-+H2↑ |
| B、向氯化铁溶液中滴加偏铝酸钠溶液:Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓ |
| C、用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、向含氯化铝的氯化镁溶液中加入氧化镁:Al3++MgO+H2O═Al(OH)3↓+Mg2+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.钠先和氢离子反应;
B.发生互促水解反应生成Fe(OH)3和Al(OH)3;
C.HClO氧化CaSO3;
D.电荷不守恒.
B.发生互促水解反应生成Fe(OH)3和Al(OH)3;
C.HClO氧化CaSO3;
D.电荷不守恒.
解答:
解:A.钠在盐酸中,首先钠和氢离子反应,应为2Na+2H+═2Na++H2↑,故A错误;
B.氯化铁和偏铝酸钠溶液发生互促水解反应,反应的离子方程式为Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓,故B正确;
C.用漂白粉溶液吸收尾气中SO2,反应的离子方程式为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故C错误;
D.向含氯化铝的氯化镁溶液中加入氧化镁,离子方程式为2Al3++3MgO+3H2O═2Al(OH)3↓+3Mg2+,故D错误.
故选B.
B.氯化铁和偏铝酸钠溶液发生互促水解反应,反应的离子方程式为Fe3++3AlO2-+6H2O═Fe(OH)3↓+3Al(OH)3↓,故B正确;
C.用漂白粉溶液吸收尾气中SO2,反应的离子方程式为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故C错误;
D.向含氯化铝的氯化镁溶液中加入氧化镁,离子方程式为2Al3++3MgO+3H2O═2Al(OH)3↓+3Mg2+,故D错误.
故选B.
点评:本题考查了离子方程式正误判断,明确物质之间的反应是解本题关键,再结合离子反应方程式的书写规则判断,易错选项是C,注意:二氧化硫能被强氧化剂氧化,为易错点.

练习册系列答案
相关题目
化学无处不在,下面说法正确的是( )
| A、“地沟油”禁止食用,但可用于制造生物柴油 |
| B、“PM2.5”是指大气中直径小于或等于2.5μm(1μm=1×10-6m)的颗粒,“PM2.5”与空气形成的分散系属于胶体 |
| C、红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品 |
| D、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A、上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B、CO2是氧化产物,且为H2CO3的酸酐 |
| C、等质量的N2O和CO2含有相等的电子数 |
| D、N2O会迅速与人体血红蛋白结合,使人中毒 |
化学实验是科学探究过程中的一神重要方法.下列有关实验的说法正确的是( )
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
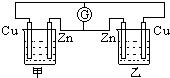 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
葡萄糖在人体中进行无氧呼吸产生乳酸,结构简式如下: ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )
 ,下列有关乳酸的说法不正确的是( )
,下列有关乳酸的说法不正确的是( )| A、乳酸能发生催化氧化、取代反应 |
| B、乳酸和葡萄糖所含官能团相同 |
| C、乳酸能和碳酸氢钠、钠反应放出气体 |
D、乳酸和 互为同分异构体 互为同分异构体 |
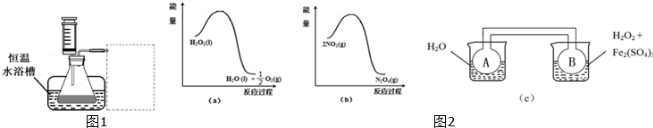
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.