题目内容
氨气在科研、生产中有广泛应用.
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)?2NH3(g)△H1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图1所示(T表示温度).
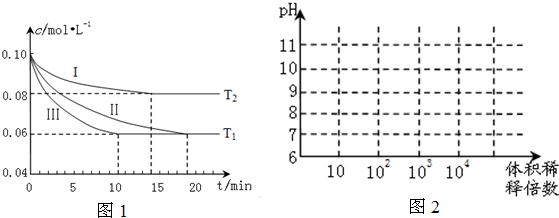
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 .
(2)常温下NH4+(aq)+H2O(l)═NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol?L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字).
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在如图2中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注).
(4)工业上用NH3消除NO污染.在一定条件下,已知每还原1mol NO,放出热量120kJ,请完成下列热化学方程式:6NO(g)+4NH3(g)═5N2(g)+6H2O(g)△H2= .
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)?2NH3(g)△H1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图1所示(T表示温度).

①实验Ⅲ在前10分钟内N2平均反应速率v(N2)=
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为
(2)常温下NH4+(aq)+H2O(l)═NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol?L-1,则NH3?H2O的电离平衡常数K=
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在如图2中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注).
(4)工业上用NH3消除NO污染.在一定条件下,已知每还原1mol NO,放出热量120kJ,请完成下列热化学方程式:6NO(g)+4NH3(g)═5N2(g)+6H2O(g)△H2=
考点:物质的量或浓度随时间的变化曲线,热化学方程式
专题:化学平衡专题
分析:(1)①根据v=
计算;
②根据c(N2)随时间(t)的变化线,可判断出平衡移动方向,再推断出采用的实验条件;
(2)根据NH3?H2O的电离方程式及水的电离和NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;
NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;
(3)根据强弱电解质在稀释过程中离子浓度的变化可以画出图;
(4)根据元素守恒及反应物的物质的量与热量的关系,可以写出热化学方程式;
| △c |
| △t |
②根据c(N2)随时间(t)的变化线,可判断出平衡移动方向,再推断出采用的实验条件;
(2)根据NH3?H2O的电离方程式及水的电离和NH4+(aq)+H2O(l)
 NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;
NH3?H2O(aq)+H+(aq)的关系,可求NH3?H2O的电离平衡常数;(3)根据强弱电解质在稀释过程中离子浓度的变化可以画出图;
(4)根据元素守恒及反应物的物质的量与热量的关系,可以写出热化学方程式;
解答:
解:(1)①v(N2)=
=
=0.004mol?L-1?min-1,故答案为:
=
=0.004mol?L-1?min-1;
②与实验Ⅱ相比,实验ⅠN2的平衡浓度变大,平衡逆向移动,且反应速率变大,所以实验Ⅰ的条件为升高温度;实验Ⅲ与实验Ⅱ相比,平衡没有移动,但反应速率变大,所以实验条件为使用催化剂;故答案为:升高温度、使用催化剂;
(2)反应NH3?H2O NH4+(aq)+OH-(aq)可以看作H2O
NH4+(aq)+OH-(aq)可以看作H2O H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l)
H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=
NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=
=1.80×10-5mol?L-1.
(3)由于氨水是弱电解质、NaOH是强电解质分别加水稀释后,氨水的PH值下降得较慢,而NaOH的PH值下降得较快,如图所示
,故答案为: ;
;
(4)根据元素守恒及电子得失守恒可得,NH3与NO反应的化学方程式为:6NO+4NH3=5N2+6H2O,由于还原1mol NO,放出热量120kJ,所以该反应的△H2=-720 kJ/mo1,所以该反应的热化学方程式为:6NO(g)+4NH3(g)=5N2(g)+6H2O(g),△H2=-720 kJ/mo1;故答案为:-720 kJ/mo1.
| △c (N2) |
| △t |
| (0.10-0.06 )mol?L-1 |
| 10min |
| △c (N2) |
| △t |
| (0.10-0.06 )mol?L-1 |
| 10min |
②与实验Ⅱ相比,实验ⅠN2的平衡浓度变大,平衡逆向移动,且反应速率变大,所以实验Ⅰ的条件为升高温度;实验Ⅲ与实验Ⅱ相比,平衡没有移动,但反应速率变大,所以实验条件为使用催化剂;故答案为:升高温度、使用催化剂;
(2)反应NH3?H2O
 NH4+(aq)+OH-(aq)可以看作H2O
NH4+(aq)+OH-(aq)可以看作H2O H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l)
H+(aq)+OH-(aq)减去反应NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=
NH3?H2O(aq)+H+(aq),则NH3?H2O的电离平衡常数K=| Kw |
| 5.55×10-10mol?L-1 |
(3)由于氨水是弱电解质、NaOH是强电解质分别加水稀释后,氨水的PH值下降得较慢,而NaOH的PH值下降得较快,如图所示

,故答案为:
 ;
;(4)根据元素守恒及电子得失守恒可得,NH3与NO反应的化学方程式为:6NO+4NH3=5N2+6H2O,由于还原1mol NO,放出热量120kJ,所以该反应的△H2=-720 kJ/mo1,所以该反应的热化学方程式为:6NO(g)+4NH3(g)=5N2(g)+6H2O(g),△H2=-720 kJ/mo1;故答案为:-720 kJ/mo1.
点评:本题考查了化学反速率的计算、影响平衡的条件、平衡常数的计算及热化学方程式的书写等知识,本题的难点在(2)中要理解氨水的电离平衡和水的电离平衡及铵根离子的水解之间的关系.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、0.1mol?L-1 Na2S溶液中含有的Na+离子数为0.2NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、标准状况下,22.4L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
化学实验是科学探究过程中的一神重要方法.下列有关实验的说法正确的是( )
| A、除去Cu2+(aq)中混有的少量Fe3+,可向其中通入过量的NH3 |
| B、在中和热测定的实验中,做三次平行实验最少要使用6次温度计 |
| C、FeCl3溶液与KSCN溶液混合,存在下述平衡:FeCl3+3KSCN?Fe(SCN)3+3KCl当达到平衡时,保持其他条件不变,可向其中加入固体KCl,来探究浓度对反应速率的影响 |
| D、常温下,用pH计测量等物质的量浓度的NaHC03和NaHS03溶液的pH,来探究H2CO3、H2SO3酸性的相对强弱 |
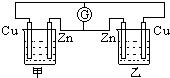 在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )
在如图的装置中,甲、乙两烧杯中都盛有相同体积的0.1mol/L的硫酸溶液,下列有关实验的叙述中,错误的是( )| A、电流计G的指针不动 |
| B、通过电流计G的电子流动方向是由下向上 |
| C、甲、乙两装置都不是电解槽 |
| D、甲装置中铜极上有气泡产生,乙装置中,[H+]会减小 |
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图所示:
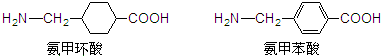
下列说法错误的是( )
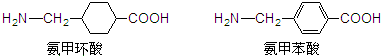
下列说法错误的是( )
| A、氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液 |
| B、氨甲苯酸属于芳香族α-氨基酸的同分异构体和苯丙氨酸互为同系物 |
| C、氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚、加成等反应 |
| D、氨甲环酸、氨甲苯酸中各有5种不同的氢原子 |
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.