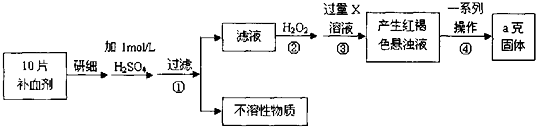
题目内容
1.在100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )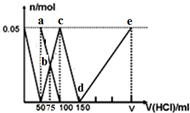
| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为表示Na2CO3、NaCl溶液;由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
第二阶段AlO2-反应完毕,开始发生反应CO32-+H+═HCO3-,b点CO32-、HCO32-的浓度相等,由图可知CO32-反应完毕,c点为NaHCO3溶液,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
第三阶段cd段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,据此进行解答.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为表示Na2CO3、NaCl溶液;由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
第二阶段AlO2-反应完毕,开始发生反应CO32-+H+═HCO3-,b点CO32-、HCO32-的浓度相等,由图可知CO32-反应完毕,c点为NaHCO3溶液,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
第三阶段cd段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
第四阶段,d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,
A.根据分析可知,a点为碳酸钠溶液,根据质子守恒可得:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故A错误;
B.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故B正确;
C.c点氯离子浓度为0.5mol/L,根据物料守恒c(HCO3-)+c(H2CO3)+c(CO32-)=0.25mol/L,则c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol•L-1,故C错误;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )| A. | 3:4:1 | B. | 5:4:1 | C. | 3:5:1 | D. | 3:5:0 |
| A. | 9gD2O和9gH2O中含有的质子数均为5NA | |
| B. | 2L0.5mol/LH2SO3溶液中含有的H+数小于2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
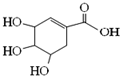
| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
| A. | $\frac{a}{576v}$mol/L | B. | $\frac{125a}{36v}$mol/L | C. | $\frac{250a}{36v}$mol/L | D. | $\frac{250a}{48v}$mol/L |
| A. | SO2 | B. | O2 | C. | NH3 | D. | HCl |
| A. | 向H2S水溶液中加入NaOH有利于S2-增多 | |
| B. | 鼓入过量空气有利于SO2转化为SO3 | |
| C. | 高压对合成氨有利 | |
| D. | 500℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应) |