题目内容
12.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 9gD2O和9gH2O中含有的质子数均为5NA | |
| B. | 2L0.5mol/LH2SO3溶液中含有的H+数小于2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
分析 A、重水的摩尔质量为20g/mol,普通水的摩尔质量为18g/mol;
B、亚硫酸为弱酸;
C、过氧化钠与水的反应中,氧元素的价态由-1价变为0价;
D、NO和氧气反应生成NO2,但NO2中存在平衡:2NO2?N2O4.
解答 解:A、重水的摩尔质量为20g/mol,普通水的摩尔质量为18g/mol,故9g重水的物质的量为0.45mol,而重水中含10个质子,故0.45mol重水中含4.5mol质子即4.5NA个,故A错误;
B、亚硫酸为弱酸,在溶液中不能完全电离,故溶液中含有的氢离子个数小于2NA个,故B正确;
C、过氧化钠与水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C错误;
D、2molNO和1mol氧气反应生成2molNO2,但NO2中存在平衡:2NO2?N2O4,故所得产物的物质的量小于2mol,即小于2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.燃烧1g乙炔生成二氧化碳和液态水放出热量50kJ,则下列热化学方程式书写正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ•mol-1 | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300 kJ | |
| C. | 2C2H2+5O2═4CO2+2H2O△H=-2 600 kJ | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 600 kJ•mol-1 |
3.有一种银锌微型纽扣电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O Ag2O+2H2O+2e-═2Ag+2OH-,电池总反应为:Ag2O+Zn═2Ag+ZnO.下列有关叙述中不正确的是( )
| A. | Zn为负极,Ag2O是正极 | |
| B. | 在使用过程中,电池负极区溶液的c(OH-)值减小 | |
| C. | 电池工作时,电子由Zn极经外电路流向Ag2O极 | |
| D. | 电路中每通过0.2mol电子,负极的质量理论上减少6.5g |
20.下列离子方程式正确的是( )
| A. | Na2C2O4水解:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | NH4HSO3溶液与少量NaOH溶液混合:HSO3-+OH-═SO32-+H2O | |
| C. | 将FeS溶液加入过量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═CO32-+2HClO |
7.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
4.下列离子方程式不正确的是( )
①氢氧化铜的悬浊液与盐酸反应:OH-+H+═H2O
②氯化铝溶液与过量氨水反应:Al3++3NH2•H2O═Al(OH)3↓+3NH4+
③小苏打溶液与饱和石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O
④苯酚钠溶液中通入过量的CO2:C6H5O-+H2O+CO2═C6H5OH↓+HCO3-.
①氢氧化铜的悬浊液与盐酸反应:OH-+H+═H2O
②氯化铝溶液与过量氨水反应:Al3++3NH2•H2O═Al(OH)3↓+3NH4+
③小苏打溶液与饱和石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O
④苯酚钠溶液中通入过量的CO2:C6H5O-+H2O+CO2═C6H5OH↓+HCO3-.
| A. | ①、② | B. | ①、③ | C. | ②、③ | D. | ①、④ |
1.在100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )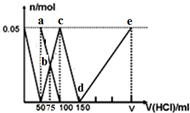

| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |
2..某溶液能够使石蕊试液变蓝,则下列离子中一定能大量共存于该溶液的是( )
| A. | HCO3-、Ag+、NO3-、Na+ | B. | Na+、Cl-、CO32-、NO3- | ||
| C. | Fe3+、Na+、Cl-、SO42- | D. | H+、Cl-、CO32-、NH4+ |
