题目内容
11.下列事实中不能用勒夏特列原理来解释的是( )| A. | 向H2S水溶液中加入NaOH有利于S2-增多 | |
| B. | 鼓入过量空气有利于SO2转化为SO3 | |
| C. | 高压对合成氨有利 | |
| D. | 500℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应) |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该过程必须是可逆的,否则勒夏特列原理不适用.
解答 解:A、硫化氢溶液中存在电离平衡H2S?HS-+H+,HS-?S2-+H+,加入碱中和氢离子,平衡正向进行有利于S2-的生成,能用勒夏特列原理解释,故A不符合;
B、存在平衡2SO2+O2(g)?2SO3(g),加入过量的空气,平衡向正反应方向移动,提高二氧化硫的转化率,能用勒夏特利原理解释,故B不符合;
C、合成氨反应N2+3H2=2NH3,反应前后气体体积减小,高压有利于合成氨反正向进行,能用勒夏特列原理解释,故C不符合;
D、合成氨反应N2+3H2=2NH3,反应是放热反应,温度升高平衡逆向进行,500℃左右比室温更利于合成氨反应,是因为此时反应速率增大,催化剂活性最大,不能用勒夏特列原理解释,故D符合;
故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.

练习册系列答案
相关题目
1.在100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )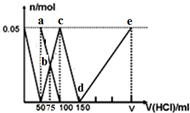

| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |
2..某溶液能够使石蕊试液变蓝,则下列离子中一定能大量共存于该溶液的是( )
| A. | HCO3-、Ag+、NO3-、Na+ | B. | Na+、Cl-、CO32-、NO3- | ||
| C. | Fe3+、Na+、Cl-、SO42- | D. | H+、Cl-、CO32-、NH4+ |
19.苯丙酸诺龙是一种兴奋剂,结构简式如下,下列有关苯丙酸诺龙的说法中正确的是( )

| A. | 苯丙酸诺龙分子中没有手性碳原子 | |
| B. | 苯丙酸诺龙属于芳香烃 | |
| C. | 苯丙酸诺龙既能使溴的四氯化碳溶液又能使酸性KMnO4溶液褪色 | |
| D. | 1mol苯丙酸诺龙最多可与2 mol的NaOH溶液反应 |
16.1体积某气态烃A最多和2体积氯化氢加成生成氯代烷烃,1mol此氯代烃能和8molCl2发生取代反应,生成物中只有碳、氯两种元素,则A的化学式为( )
| A. | C3H6 | B. | C2H4 | C. | C4H6 | D. | C2H2 |
3.下列有关阿佛加德罗常数(NA)的说法错误的是( )
| A. | 0.5mol H2O含有的原子数目为1.5NA | |
| B. | 32g O2所含的原子数目为NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
20.下列判断正确的是( )
| A. | 盐酸是化合物 | B. | 只含有一种元素的物质一定是单质 | ||
| C. | CO2、SO2是酸性氧化物 | D. | 纯净物只含有一种元素 |
1.下列说法不正确的是( )
| A. | 干冰可用于人工降雨 | |
| B. | 过氧化钠常用作航天员的供氧剂 | |
| C. | 乘车严禁携带易燃、易爆等危险品 | |
| D. | 大量开采、使用可燃冰不会对环境造成影响 |
 .
.