题目内容
11. 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )| A. | 3:4:1 | B. | 5:4:1 | C. | 3:5:1 | D. | 3:5:0 |
分析 能与氢气发生反应的为苯环,酚-OH、-COOH、-COO-、Br与NaOH反应,含有酚羟基,可与溴水发生取代反应,以此解答.
解答 解:只有苯环与氢气发生加成反应,1mol有机物消耗3mol氢气;酚-OH、-COOH、-COO-、Br与NaOH反应,1mol有机物消耗5molNaOH,只有酚羟基邻位的1个氢原子可别溴取代,则1mol有机物消耗1mol溴,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,注意把握官能团、性质的关系为解答的关键,熟悉苯酚、酯、酸的性质即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等均为离子化合物,通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列碳化物水解后的有机产物相同的是( )
①ZnC2
②Al4C3
③Mg2C3
④Li2C2.
①ZnC2
②Al4C3
③Mg2C3
④Li2C2.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
2.燃烧1g乙炔生成二氧化碳和液态水放出热量50kJ,则下列热化学方程式书写正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ•mol-1 | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300 kJ | |
| C. | 2C2H2+5O2═4CO2+2H2O△H=-2 600 kJ | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 600 kJ•mol-1 |
19.两种有机物A、B取等质量完全燃烧,生成的CO2与消耗氧气的量分别相同,这两种有机物之间的关系正确的是( )
| A. | 互为同分异构体 | B. | 互为同系物 | C. | 只能是同种物质 | D. | 最简式一定相同 |
6.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③熔点:SO3>SiO2>CO2
④结合质子能力:OH->CH3COO->Cl-.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③熔点:SO3>SiO2>CO2
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
3.有一种银锌微型纽扣电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O Ag2O+2H2O+2e-═2Ag+2OH-,电池总反应为:Ag2O+Zn═2Ag+ZnO.下列有关叙述中不正确的是( )
| A. | Zn为负极,Ag2O是正极 | |
| B. | 在使用过程中,电池负极区溶液的c(OH-)值减小 | |
| C. | 电池工作时,电子由Zn极经外电路流向Ag2O极 | |
| D. | 电路中每通过0.2mol电子,负极的质量理论上减少6.5g |
20.下列离子方程式正确的是( )
| A. | Na2C2O4水解:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | NH4HSO3溶液与少量NaOH溶液混合:HSO3-+OH-═SO32-+H2O | |
| C. | 将FeS溶液加入过量稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═CO32-+2HClO |
1.在100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示.下列说法正确的是( )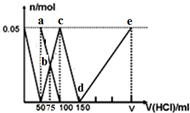

| A. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol•L-1 | |
| D. | d→e的过程中水的电离程度逐渐减小 |