题目内容
18.下列五种物质中①Ne ②H2O ③HCl④KOH ⑤Na2O2,既存在共价键又存在离子键的是④⑤,不存在化学键的是①,属于共价化合物的是②③(上述均填写序号).编号为③的物质溶于水时破坏分子间作用力(填写离子键、共价键或分子间作用力)分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,单原子分子中不存在化学键,据此分析解答.
解答 解:这几种物质中Ne是单原子分子,不含化学键;水分子中O-H原子之间中存在共价键,为共价化合物;HCl中H-Cl原子之间存在共价键,为共价化合物;KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物;过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,为离子化合物;
既存在共价键又存在离子键的是④⑤,不存在化学键的是①,属于共价化合物的是②③,③的物质溶于水时破坏分子间作用力,
故答案为:④⑤;①;②③;分子间作用力.
点评 本题考查化学键,为高频考点,明确离子键和共价键区别是解本题关键,侧重考查学生分析判断能力,注意:并不是所有物质中都存在化学键,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
13.升高温度能加快反应速率的主要原因是( )
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
3.恒温时,在密闭容器中进行可逆反应:N2+3H2?2NH3,达到平衡后,欲使正反应速率增大,可采取的措施是( )
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
2.将5mL 10mol/L的硫酸稀释到100mL,所得硫酸溶液的物质的量浓度是( )
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.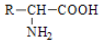 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
. .
.