题目内容
4.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g).将0.050mol的SO2(g)和0.030mol的O2(g)注入体积为2.0L的密闭反应器,并置于某温度为450℃下的恒温环境中,达到化学平衡后,测的反应器中有0.04mol SO3(g),求(1))用“始转末”三段式该温度下反应的平衡常数及平衡时SO2的平衡转化率.
(2)该反应到达平衡的标志bd(填字母)
a.V(O2)正=2V(SO3)逆
b.容器中O2的质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化.
分析 (1)达到化学平衡后,测的反应器中有0.04mol SO3(g),则
2SO2(g)+O2(g)?2SO3(g)
始(mol•L-1) 0.025 0.015 0
转(mol•L-1) 0.02 0.01 0.02
平衡(mol•L-1) 0.005 0.005 0.02
结合K为生成物浓度幂之积与反应物浓度幂之积的比、转化率=$\frac{转化的量}{开始的量}$×100%计算;
(2)结合平衡的特征“等、定”及衍生的物理量判定平衡状态.
解答 解:(1)达到化学平衡后,测的反应器中有0.04mol SO3(g),则
2SO2(g)+O2(g)?2SO3(g)
始(mol•L-1) 0.025 0.015 0
转(mol•L-1) 0.02 0.01 0.02
平衡(mol•L-1) 0.005 0.005 0.02
K=$\frac{(0.02)^{2}}{(0.005)^{2}×0.005}$=3200 L/mol,
SO2的平衡转化率为$\frac{0.02}{0.025}$×100%=80%,
答:反应的平衡常数为3200 L/mol,平衡时SO2的平衡转化率为80%;
(2)a.V(O2)正=2V(SO3)逆,则$\frac{V({O}_{2})正}{V(S{O}_{3})逆}$=$\frac{2}{1}$,不等于化学计量数之比,则不是平衡状态,故a不选;
b.容器中O2的质量不随时间而变化,符合平衡特征“定”,为平衡状态,故b选;
c.气体的质量、体积均不变,容器中气体的密度始终不随时间而变化,不能判定平衡状态,故c不选;
d.该反应为气体物质的量前后不等的反应,容器中气体的分子总数不随时间而变化,符合平衡特征“定”,为平衡状态,故d选;
故答案为:bd.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算、平衡判定为解答的关键,侧重分析与应用能力的考查,注意利用平衡浓度计算K,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案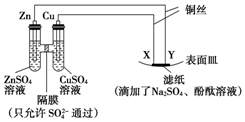
| A. | X为正极,发生氧化反应 | B. | Y与滤纸接触处有氧气生成 | ||
| C. | X为阳极,发生氧化反应 | D. | X与滤纸接触处变红 |
(1)已知2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的关键反应.如图1为不同温度(T1、T2)下SO2的转化率随时间的变化曲线.
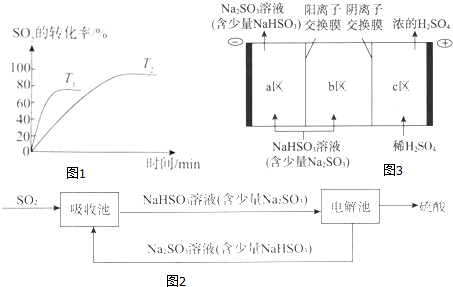
①T1>(填“>”“<”或“=”)T2,判断的依据是温度越高反应速率越快,达到化学平衡的时间越短;该反应为放(填“放”或“吸”)热反应,判断的依据是温度升高时平衡向吸热方向移动,SO2的转化率减小.
②如表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率.
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
ii.投料比为8:10时,平衡混合气体中SO3体积分数为50%.
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如图2:
①吸收池中发生反应的离子方程式是SO2+SO32-+H2O=2HSO3-.
②电解池的构造示意图如图3:
i.在图中标示出b区的Na+和HSO3-的移动方向.
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:SO2.
 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.(1)尿素[OC(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子 (选填“离子”或“共价”)化合物.
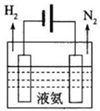
(2)液氨是一种重要的制冷剂,制冷过程中气态氨转变为液氨将释放 (选填“吸收”或“释放“)能童.液氨也是一种“贮氢”材料,液氨可通过如图装置释放氢气,该过程中能童转化方式为电能转化为化学能.
(3)已知拆开1mol气态物质中某种共价键需要吸收的能星就是该共价键的键能,某些共价键的键能见下表:
| 共价键 | H-H | N-H | N=N |
| 键能/kJ•mol-1 | 436 | 390.8 | 946 |
(4)氨气可作为脱硝剂.在恒温恒容密闭荇器中充入NO和NH3,在一定条件下发生了反 应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g).已知反应开始时NO的物质的量浓度是1.2mol•L-1,2min后,NH3的物质的量浓度从开始的1.0mol•L-1降到 0.8mol•L-1,则
①2min末NO的物质的量浓度为0.9mol/L.
②这2min内N2的平均反应速率为0.125mol/(L•min).
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品. 若用1000kg含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
实验小组拟用0.8mol•L-1 KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 40 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(1)写出该反应的离子方程式4H++4I-+O2=2I2+2H2O;
(2)为确保A组实验在40℃下进行,实验操作是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案,填写空格.以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值设计酸体积<10mL时,t预测值要小于同温对比值,设计酸体积>10mL时,t预测值要大于同温对比值,并写出与你预测相对应的探究实验的结论其他条件不变时,酸度越大反应速率越快.