题目内容
13.升高温度能加快反应速率的主要原因是( )| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
分析 升高温度增大活化分子百分数,增大活化分子有效碰撞机会,据此分析解答.
解答 解:A.升高温度,使部分非活化分子吸收热量而变为活化分子,即增大活化分子百分数,增大活化分子有效碰撞机会,化学反应速率加快,故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确温度、浓度、压强、催化剂等方法对化学反应速率影响原理是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.下列有关电解质溶液的说法正确的是( )
| A. | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等 | |
| B. | 将CH3COONa溶液从25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{{c(N{H_4}^+)}}{{c(N{O_3}^-)}}$<1 | |
| D. | 向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$增大 |
5.如图所示,下列叙述正确的是( )


| A. | X为正极,发生氧化反应 | B. | Y与滤纸接触处有氧气生成 | ||
| C. | X为阳极,发生氧化反应 | D. | X与滤纸接触处变红 |
16.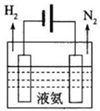 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
(1)尿素[OC(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子 (选填“离子”或“共价”)化合物.
(2)液氨是一种重要的制冷剂,制冷过程中气态氨转变为液氨将释放 (选填“吸收”或“释放“)能童.液氨也是一种“贮氢”材料,液氨可通过如图装置释放氢气,该过程中能童转化方式为电能转化为化学能.
(3)已知拆开1mol气态物质中某种共价键需要吸收的能星就是该共价键的键能,某些共价键的键能见下表:
则合成氨反应:N2(g)+3H2(g) 2NH3(g)△H=-90.8kJ•mol-1.
(4)氨气可作为脱硝剂.在恒温恒容密闭荇器中充入NO和NH3,在一定条件下发生了反 应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g).已知反应开始时NO的物质的量浓度是1.2mol•L-1,2min后,NH3的物质的量浓度从开始的1.0mol•L-1降到 0.8mol•L-1,则
①2min末NO的物质的量浓度为0.9mol/L.
②这2min内N2的平均反应速率为0.125mol/(L•min).
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品. 若用1000kg含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
 氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.
氨在化肥生产、制冷、“贮氢”及燃煤烟气脱硝脱硫等领域用途非常广泛.(1)尿素[OC(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子 (选填“离子”或“共价”)化合物.
(2)液氨是一种重要的制冷剂,制冷过程中气态氨转变为液氨将释放 (选填“吸收”或“释放“)能童.液氨也是一种“贮氢”材料,液氨可通过如图装置释放氢气,该过程中能童转化方式为电能转化为化学能.
(3)已知拆开1mol气态物质中某种共价键需要吸收的能星就是该共价键的键能,某些共价键的键能见下表:
| 共价键 | H-H | N-H | N=N |
| 键能/kJ•mol-1 | 436 | 390.8 | 946 |
(4)氨气可作为脱硝剂.在恒温恒容密闭荇器中充入NO和NH3,在一定条件下发生了反 应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g).已知反应开始时NO的物质的量浓度是1.2mol•L-1,2min后,NH3的物质的量浓度从开始的1.0mol•L-1降到 0.8mol•L-1,则
①2min末NO的物质的量浓度为0.9mol/L.
②这2min内N2的平均反应速率为0.125mol/(L•min).
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品. 若用1000kg含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
17.同温同压下,相同体积的N2和NO具有相同的( )
| A. | 电子数 | B. | 质量 | C. | 原子数 | D. | 氮原子数 |
