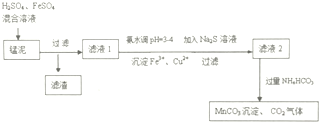
题目内容
10.利用钴渣[含Co203•CoO、少量Fe2O3等金属氧化物,氧化性:Co3+>Fe3+],制备钴氧化物的工艺流程如图: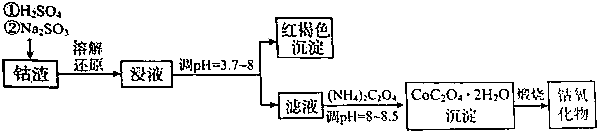
(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
分析 利用钴渣[含Co203•CoO、少量Fe2O3等金属氧化物,制备钴氧化物的工艺流程为,将钴渣加硫酸溶解后为钴离子和铁离子等,钴离子和铁离子与亚硫酸钠发生氧化还原反应生成亚钴离子和亚铁离子,调节溶液的pH值,将浸液在空气中搅拌,使亚铁离子生成氢氧化铁沉淀,过滤后在滤液中加入草酸铵调节溶液pH值,生成草酸钴晶体沉淀,煅烧CoC2O4晶体生成钴氧化物,
(1)Co203与亚硫酸根反应生成钴离子和硫酸根离子;
(2)亚铁离子被空气中氧气氧化成铁离子水解得到氢氧化铁,然后加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成;
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液,阳极上亚钴离子发生氧化反应生成氧化钴,阴极上铜离子放电生成铜,若电解液中不加入CuSO4,阴极上Co3+获得电子生成Co2+,Co2+的利用率降低;
(4)计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g-4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;210℃~320℃过程中是CoC2O4发生的反应,210℃~320℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,依据原子守恒配平书写反应的化学方程式,据此书写化学方程式;
解答 解:(1)Co203与亚硫酸根反应生成钴离子和硫酸根离子,反应的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)亚铁离子被空气中氧气氧化成铁离子水解得到氢氧化铁反应的离子方程式为4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,然后加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成,
故答案为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成;
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液,阳极上亚钴离子发生氧化反应生成氧化钴,电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,阴极上铜离子放电生成铜,若电解液中不加入CuSO4,阴极上Co3+获得电子生成Co2+,Co2+的利用率降低,
故答案为:2Co2+-2e-+3H2O=Co2O3+6H+; 阴极上Co3+获得电子生成Co2+,Co2+的利用率降低;
(4)计算晶体物质的量n=$\frac{5.49g}{183g/mol}$=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150℃~210℃固体质量变化=5.49g-4.41g=1.08g,说明210℃失去结晶水得到CoC2O4;210℃~320℃过程中是CoC2O4发生的反应,210℃~320℃过程中产生的气体只有CO2 ,依据元素守恒得到生成CO2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加反应的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O2物质的量=$\frac{0.064g}{32g/mol}$=0.02mol,则:n(CoC2O4):n(O2):n(CO2)=0.03:0.02:0.06=3:2:6,
方程式计量系数之比等于转化量之比,所以该反应的方程式为:3CoC2O4+2O2$\frac{\underline{\;210℃~320℃\;}}{\;}$Co3O4+6CO2,
故答案为:3CoC2O4+2O2$\frac{\underline{\;210℃~320℃\;}}{\;}$Co3O4+6CO2;
点评 本题考查物质的分离和提纯,侧重考查学生分析判断能力,涉及氧化还原反应、离子反应等知识点,为高频考点,明确流程图中发生的反应及基本操作、确定各个阶段固体成分及先后分解生成物成分是解本题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 |
| C | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
| D | 验证醋酸、碳酸、硅酸酸性强弱 | NaOH溶液 | Na2SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
| A. | HCl | B. | NH3 | C. | CH4 | D. | CO2 |
| A. | 气态单质分子中一定存在共价键 | |
| B. | 氯化钠熔化或氯化氢溶于水时都要破坏化学键 | |
| C. | 金属甲、乙各1mol均和足量的盐酸反应,甲比乙失电子多,说明甲的金属性比乙的金属性强 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
①称取3g干海带,用刷子把干海带表面的附着物刷净.
②将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中.
③用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却.
④将海带灰转移到小烧杯中,再向烧杯中加入10mL蒸馏水,搅拌,煮沸2~3min,使可溶物溶解,过滤.
⑤向滤液中滴入几滴硫酸,再加入约1mL H2O2溶液,观察现象.
下列说法正确的是( )
| A. | 步骤①中也可以用水洗涤除去海带表面的附着物 | |
| B. | 步骤④过滤操作需要两种玻璃仪器 | |
| C. | 步骤⑤所得的溶液中加入淀粉可看到蓝色现象 | |
| D. | 通过以上①~⑤步骤即可得到纯度高的I2 |