题目内容
1.某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白.(1)不用做任何实验就可以肯定溶液中不存在的离子是Fe3+、Cu2+;
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是Ag+,有关反应的离子方程式为Cl-+Ag+═AgCl↓;
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有Mg2+,有关反应的离子方程式为Mg2++2OH-═Mg(OH)2↓;
(4)原溶液中可能大量存在的阴离子是B.
A、Cl-B、N${O}_{3}^{-}$ C、C${O}_{3}^{2-}$ D、OH-.
分析 (1)有颜色的离子不用做实验就能判断是否存在;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;
(3)能和NaOH溶液反应的离子是Mg2+;
(4)溶液中一定含银离子,与银离子结合生成沉淀的不能存在.
解答 解:(1)有颜色的离子不用做实验就能判断是否存在,溶液无色说明不含Cu2+、Fe3+,故答案为:Cu2+、Fe3+;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,离子反应方程式为:Ag++Cl-=AgCl↓,故答案为:Ag+;Ag++Cl-=AgCl↓;
(3)能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2OH-═Mg(OH)2↓,故答案为:Mg2+;Mg2++2OH-═Mg(OH)2↓;
(4)原溶液中存在Ag+,则Cl- 不能共存,原溶液中肯定有Mg2+,故CO32-、OH-不能与其共存,硝酸根离子不与所给的任何离子生成沉淀,故溶液中可能大量存在的离子是硝酸根,故选B.
点评 本题主要考查的是离子的检验,根据离子的颜色、离子之间的反应来分析解答,知道铁离子、亚铁离子、硫酸根离子、氯离子、铵根离子的检验方法及现象,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
20.下列反应过程中的能量变化情况符合如图的是( )
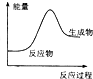

| A. | 氧化钙溶于水 | B. | 碳酸钙高温煅烧分解 | ||
| C. | 酸和碱的中和反应 | D. | 铝粉与氧铁粉末反应 |
1.下列各组物质,互为同位素的是( )
| A. | 11H2和21H2 | B. | H2O和D2O | C. | 235U 和 238U | D. | O2和O3 |
10.利用钴渣[含Co203•CoO、少量Fe2O3等金属氧化物,氧化性:Co3+>Fe3+],制备钴氧化物的工艺流程如图:

(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
经测定,210℃~320℃过程中,产生的气体只有CO2,则此过程发生的化学反应方程式为3CoC2O4+2O2$\frac{\underline{\;210℃~320℃\;}}{\;}$Co3O4+6CO2.

(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
11.用已知浓度的NaOH滴定未知浓度的盐酸,下列操作(其他操作正确) 会造成测定结果偏高的是( )
| A. | 滴定终点读数时俯视读数 | |
| B. | 锥形瓶洗净后未干燥 | |
| C. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 |
 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.