题目内容
18.25℃时,几种银盐的Ksp及固体的颜色如表:| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
分析 A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.写出反应方程式,然后结合平衡常数表达式及氯化银、硫化银的溶度积进行计算;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.
解答 解:A.根据表格知道,Ag2CrO4溶解度比Ag2S的溶度积小,结构相似,溶度积越小,溶解度越小,故A错误;
B.氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq),该反应的平衡常数为:K=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$═$\frac{{c}^{2}(A{g}^{+})•{c}^{2}(C{l}^{-})}{{c}^{2}(A{g}^{+})•c({S}^{2-})}$=$\frac{{K}^{2}sp(AgCl)}{Ksp(A{g}_{2}S)}$=$\frac{(1.8×1{0}^{-10})^{2}}{6.0×1{0}^{-50}}$=5.4×1029,故B正确;
C.Ag2S、Ag2CrO4,的溶度积常数均比氯化银小,故不可用K2CrO4或K2S溶液作指示剂,故C错误;
D.某混合溶液中KBr、KCl、KI的浓度均为0.01mol•L-1,向该溶液中逐滴加入0.01mol•L-1AgNO3溶液,依据氯化银、溴化银、碘化银阴阳离子比相同,可以用溶度积常数比较判断,溶解性大小顺序是AgCl>AgBr>AgI-、所以生成沉淀的顺序是先生成溶解度小的,在生成溶解度较大的沉淀,先后产生沉淀的离子次序为I-、Br-、Cl-;生成的沉淀分别为碘化银沉淀,溴化银沉淀,氯化银沉淀,颜色分别为:黄色、浅黄色、白色,故D错误.
故选B.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.

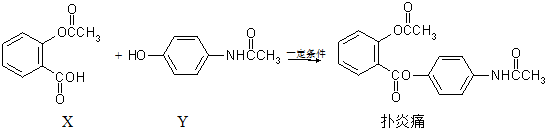
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
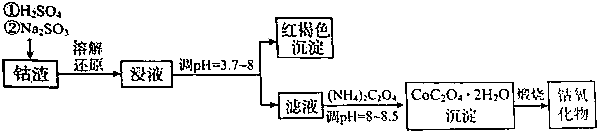
(1)Co203“溶解还原”的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)将浸液在空气中搅拌,生成红褐色絮状物,用离子方程式表示过程变化4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.然后加入NH4HCO3调节pH=3.7~8时有大量红褐色沉淀生成,解释其原因加入NH4HCO3调节pH=3.7~8时则促进铁离子的水解,因而有大量红褐色沉淀生成.
(3)以石墨做电极,电解CoSO4和CuSO4的混合溶液可以制得Co2O3.阳极发生的电极反应式为2Co2+-2e-+3H2O=Co2O3+6H+,观察到阴极石墨电极上包裹铜层;若电解液中不加入CuSO4时,出现的主要问题是阴极上Co3+获得电子生成Co2+,Co2+的利用率降低.
(4)在空气中煅烧CoC2O4•2H2O(M为183g/mol),在不同温度下分别得到一种固体物质,充分煅烧5.49g该晶体,测得其残留质量如表:
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是
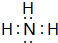 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. (2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为离子键、共价键.
(3)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),证明存在该阳离子.

| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |




 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.