题目内容
14.在恒温时,在固定容器中充入N2O4,发生反应N2O4(g)?2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将B(A.增大、B.减小、C.不变).分析 在恒温恒容条件下,再向容器内充入一定量的N2O4,等效为在原平衡的基础上增大压强,平衡逆向移动,以此解答该题.
解答 解:反应物和生成物都只有一种,在恒温恒容条件下,再向容器内充入一定量的N2O4,等效为在原平衡的基础上增大压强,平衡逆向移动,则NO2的体积分数减小,
故答案为:B.
点评 本题考查化学平衡的影响因素,为高频考点,侧重于学生的分析能力的考查,难度中等,构建平衡建立的途径是解题的关键,注意把握反应的特征,有一定的难度.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| C. | 若①2H2(g)+O2(g)═2H2O(g)△H=-akJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H=-bkJ•mol-1,则 a>b | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
2.用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(方框号内),溶液能与原溶液完全一样的是( )
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
19.亚硝酸氯(ClNO)是有机合成中的重要试剂.可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)?2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
则2NO(g)+C12(g)?2C1NO(g)反应的△H和a的关系为△H=289-2akJ/mol.
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
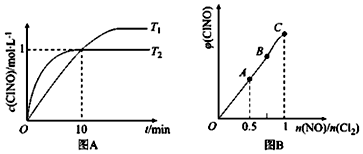
由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
6.Fe(OH)3胶体的说法,正确的是( )
| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题: