题目内容
6.Fe(OH)3胶体的说法,正确的是( )| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
分析 A.胶体具有丁达尔现象,而溶液不具有;
B.通电时胶粒向直流电源的负极移动,证明胶体微粒吸附带电荷的离子,这种现象称为电泳;
C.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热;
D.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热.
解答 解:A.胶体具有丁达尔现象,而溶液不具有,则丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液,可用渗析分离Fe(OH)3胶体和FeCl3溶液,故A错误;
B.Fe(OH)3胶体带正电荷,在通电时胶体微粒向直流电源的负极移动,这种现象称为电泳,故B正确;
C.向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,可制备胶体,故C正确;
D.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液得到氢氧化铁沉淀得不到氢氧化铁胶体,故D错误.
故选BC.
点评 本题考查胶体的制备与性质,为高频考点,旨在考查学生对基础知识的识记,注意基础知识的积累掌握,题目难度不大.

练习册系列答案
相关题目
16.下列物质的主要成分属于硅酸盐的是( )
| A. | 石灰石 | B. | 石英 | C. | 纯碱 | D. | 陶瓷 |
11.二甲醚(CH3OCH3)被称为21世纪的新型燃料,未来可能替代柴油和液化气作为洁净液体燃料使用.
(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)???CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;.

(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)>(填“>”“<”或“=”)v(逆).
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.
(1)工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)???CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
现在采用新工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应的△H=(2a+b+c)kJ•mol-1,平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$.
(2)增大压强,CH3OCH3的产率增大(填“增大”“减小”或“不变”).
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.新工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率.
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气的组成、压强、反应时间等因素不变,实验结果如图.CO转化率随温度变化的规律是温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;.

(5)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
②若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH的转化率α(CH3OH)=97.5%.
8.如表是周期表中的一部分,根据A-K在周期表中的位置,用元素符号或化学式回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是K.
(2)最高价氧化物的水化物碱性最强的是KOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF,
(4)在这些元素中(除I外),原子半径最大的是K,原子半径最小的是F
(5)D和K组成化合物的电子式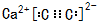 ,
,
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
(2)最高价氧化物的水化物碱性最强的是KOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF,
(4)在这些元素中(除I外),原子半径最大的是K,原子半径最小的是F
(5)D和K组成化合物的电子式
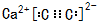 ,
,(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+2H2O.
9.CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H1.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为300℃、500℃的密闭容器中,甲醇的物质的量;图2:温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数).下列叙述正确的是( )
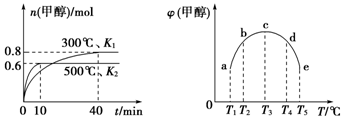

| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
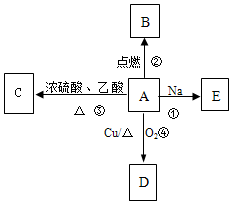 A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:
A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题: