题目内容
4.下列说法正确的是( )| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| C. | 若①2H2(g)+O2(g)═2H2O(g)△H=-akJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H=-bkJ•mol-1,则 a>b | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
分析 A.弱电解质电离吸热,浓硫酸稀释放热,且生成沉淀时放热;
B.铜导热性能强于玻璃;
C.气态水变成液态水要放热;
D.吸热反应也可能自发进行.
解答 解:A.弱电解质电离吸热,浓硫酸稀释放热,且生成沉淀时放热,则酸与碱发生中和反应生成1 mol H2O的过程中,能量不一定相同,故A错误;
B.中和热测定实验成败的关键是保温工作,金属铜的导热效果好于环形玻璃搅拌棒,所以测量出的中和热数值偏小,故B正确;
C.气态水变成液态水要放热,所以反应①2H2(g)+O2(g)═2H2O(g)△H=-akJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H=-bkJ•mol-1,则 a<b,故C错误;
D.吸热反应也可能自发进行,如碳酸氢铵常温下能自发进行,但是该反应为吸热反应,故D错误.
故选B.
点评 本题考查了化学反应中的能量变化,反应自发性的判断等,属于基础知识的考查,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
12.有一种有机物A具有抗癌作用,其结构简式为: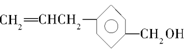 ,下列关于有机物A的说法错误的是( )
,下列关于有机物A的说法错误的是( )
 ,下列关于有机物A的说法错误的是( )
,下列关于有机物A的说法错误的是( )| A. | 有机物A可以与氯气反应 | |
| B. | 有机物A与 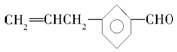 互为同分异构体 互为同分异构体 | |
| C. | 有机物A可与CH3COOH发生酯化反应 | |
| D. | 有机物A可以使酸性KMnO4溶液褪色 |
19.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:
SO2+2Fe3++2H2O═SO42-+4H++2Fe2+,
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
下列说法正确的是( )
SO2+2Fe3++2H2O═SO42-+4H++2Fe2+,
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
下列说法正确的是( )
| A. | Cr2O72-不能将SO2氧化 | B. | 还原性:Cr3+>Fe2+>SO2 | ||
| C. | 氧化性:Cr2O72->Fe3+>SO2 | D. | 两个反应中Fe3+均表现还原性 |
9.温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容条件,已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1测得反应达到平衡时的有关数据如表,则下列选项正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系的压强(Pa) | p1 | p2 | p3 |
| 反应物的转化率 | a1 | a2 | a3 |
| A. | a+b=92.4 | B. | 2c1>c3 | C. | 2p2<p3 | D. | α1+α3=1 |
16.下列物质的主要成分属于硅酸盐的是( )
| A. | 石灰石 | B. | 石英 | C. | 纯碱 | D. | 陶瓷 |
 .
.