��Ŀ����
9�� ����18mol/L��ŨH2SO4������100mL 3.6mol/L��ϡ���ᣮ�ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ��������ƽ����ش��������⣺
����18mol/L��ŨH2SO4������100mL 3.6mol/L��ϡ���ᣮ�ɹ�ѡ��������У��ٲ����� ����ƿ ���ձ� �ܽ�ͷ�ι� ����Ͳ ��������ƽ����ش��������⣺��1�����������У�������ϡH2SO4ʱ����Ҫʹ�õ��Тڢޣ�����ţ�����ȱ�ٵ�������100ml����ƿ��
��2�������㣬����ȡŨH2SO4�����Ϊ19.6 mL��
��3�����Ʋ��裺��ȡŨ���ᣬС�ĵص���ʢ����������ˮ���ձ��У�������ȣ�����ȴ�����º�ת�Ƶ�100mL����ƿ�У�������������ˮ���ձ�������ϴ��2��3�Σ�ÿ��ϴ��ҺҲת�Ƶ�����ƿ�У�Ȼ��С�ĵ�������ƿ�м�������ˮ���̶��ߣ����ݣ�����ƿ�����������µߵ�ҡ�ȣ�
�ٶ��ݵ���ȷ�����Ǽ���������ˮ����̶�����1-2cmʱ�����ý�ͷ�ιܼ�ˮ����Һ����ʹ���̶������У�
���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ������ķ������������ƣ�����ţ���
A����������Һ�壬ʹ��Һ����̶�������
B��С�ļ�������ƿ����������ʹ��Һ����̶�������
C�����������һ������Ũ����
D����������
��4������ʱ���в����ᵼ��������ҺŨ��ƫ�ߵ���be��
a��ת��ʱ��������Һ���� b������ʱ���ӿ̶���
c������ƿ������ˮϴ����δ���� d������Ͳ��ȡŨ����ʱ�����ӿ̶���
e��ϡ�ͺ�δ����ȴ��ת�ƶ���
��5��ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ�����еĴ�����û���ò�����������
���� ��1����������һ�����ʵ���Ũ����Һ�IJ�������ѡȡʵ��������
��2������C=$\frac{1000�Ѧ�}{M}$����Ũ��������ʵ���Ũ�ȣ�������Һϡ��ǰ�����ʵ����ʵ��������������Ũ������Һ�������
��3���ٶ���ʱע�ⲻ�ܳ����̶��ߣ����ý�ͷ�ιܵμӣ�
���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ�Ӧ�������ƣ�
��4�������������������ʵ����ʵ�������Һ�������Ӱ�죬����C=$\frac{n}{V}$������������
��5����ҺʱӦ��ֹ��Һ��������������
��� �⣺��1������һ�����ʵ���Ũ��������Һ��һ�㲽���У���ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡŨ������Һ���ձ���ϡ�ͣ���ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ�������в���������Ͳ����ͷ�ιܡ�С�ձ���500ml����ƿ�������ò�������������ƿ��������ƽ����ȱ�ٵ�����Ϊ��100ml����ƿ��
�ʴ�Ϊ���ڢޣ�100ml����ƿ��
��2����������98%�ܶ�Ϊ1.84g•cm-3ŨH2SO4�����ʵ���Ũ��=$\frac{1000��1.84��98%}{98}$mol/L=18.4mol/L������ҪŨ������Һ�����ΪV��3.6mol•L-1��100mL=V��18.4mol/L����ã�V=19.6mL��
�ʴ�Ϊ��19.6mL��
��3���ٶ��ݵ���ȷ�����Ǽ���������ˮ����̶���1-2cm�����ý�ͷ�ιܼ�ˮ����Һ����ʹ���̶������У�
�ʴ�Ϊ��1-2cm��
���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ�ʵ��ʧ�ܣ��������ȣ������������ƣ�
�ʴ�Ϊ���������ƣ�
��4��a��ת��ʱ��������Һ�������ᵼ��Ũ��ƫ�ͣ�
b������ʱ���ӿ̶��ߣ��������ƫС����Ũ��ƫ��
c������ƿ������ˮϴ����δ�����ʵ����Ӱ�죻
d������Ͳ��ȡŨ����ʱ�����ӿ̶��ߣ�������ȡҺ��ƫС��������Ũ��ƫС��
e��ϡ�ͺ�δ����ȴ��ת�ƶ��ݣ��ɵ���Һ�����ƫС��Ũ��ƫ��
�ʴ�Ϊ��be��
��5����ҺʱӦ��ֹ��Һ������Ӧ�ò������������ʴ�Ϊ��û���ò�����������
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƣ�Ϊ��Ƶ���㣬������ѧ���ķ���������ʵ�������Ŀ��飬��Ϥ����ԭ�������ǽ���ؼ���ת������ƿ��ѡ���ʹ��ע�����ע�����ķ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�SO2+2Fe3++2H2O�TSO42-+4H++2Fe2+��
Cr2O72-+6Fe2++14H+�T2Cr3++6Fe3++7H2O��
����˵����ȷ���ǣ�������
| A�� | Cr2O72-���ܽ�SO2���� | B�� | ��ԭ�ԣ�Cr3+��Fe2+��SO2 | ||
| C�� | �����ԣ�Cr2O72-��Fe3+��SO2 | D�� | ������Ӧ��Fe3+�����ֻ�ԭ�� |
| A�� | �ϳɰ���ҵ������ѹǿ����߷�Ӧ���ת���� | |
| B�� | ��������ֽ�Ӷ���������������ʹ��λʱ���ڲ��������������� | |
| C�� | ��ӦCO��g��+NO2��g���TCO2��g��+NO��g��������ӦΪ���ȷ�Ӧ������ƽ��������¶���ϵ��ɫ���� | |
| D�� | ����ɫ����ˮ���պ���ɫ��dz |
��1����ҵ������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��???CH3OH��g����H=a kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=b kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H=c kJ•mol-1
���ڲ����¹��յ��ܷ�ӦΪ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g�����÷�Ӧ�ġ�H=��2a+b+c��kJ•mol-1��ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OC{H}_{3}��c��C{O}_{2}��}{{c}^{3}��CO��{c}^{3}��{H}_{2}��}$��
��2������ѹǿ��CH3OCH3�IJ��������������С�����䡱����
��3��ԭ�����з�Ӧ�ٺͷ�Ӧ�ڷֱ��ڲ�ͬ�ķ�Ӧ���н��У���Ӧ�۷������¹����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ���Ƿ�Ӧ�������˷�Ӧ���еIJ���H2O��ʹ��Ӧ�ڵĻ�ѧƽ��������Ӧ�����ƶ����Ӷ����CH3OCH3�IJ��ʣ�
��4��Ϊ��Ѱ�Һ��ʵķ�Ӧ�¶ȣ��о��߽�����һϵ��ʵ�飬ÿ��ʵ�鱣��ԭ��������ɡ�ѹǿ����Ӧʱ������ز��䣬ʵ������ͼ��COת�������¶ȱ仯�Ĺ������¶ȵ���240��ʱ��CO��ת���������¶ȵ����߶������¶ȸ���240��ʱ��CO��ת���������¶ȵ����߶���С����ԭ�����ڽϵ���ʱ������Ӧ��ϵ��δ�ﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ����Ӱ�죬�����¶ȵ����߷�Ӧ��������CO��ת����Ҳ�����ڽϸ���ʱ������Ӧ��ϵ���Ѵﵽƽ�⣬CO��ת������Ҫ�ܷ�Ӧ��Ӱ�죬�����¶ȵ�����ƽ�����淴Ӧ�����ƶ���CO��ת���ʼ�С����

��5����֪��Ӧ��2CH3OH��g��?CH3OCH3��g��+H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol•L-1 | 0.64 | 0.50 | 0.50 |
������ʼֻ����CH3OH����10min��Ӧ�ﵽƽ�⣬ƽ��ʱCH3OH��ת���ʦ���CH3OH��=97.5%��
| A�� | ��ѧ�仯һ�����������仯 | |
| B�� | ��ѧ�仯һ���л�ѧ���Ķ��Ѻ����� | |
| C�� | ��ѧ�仯һ���������ʵ�״̬�仯 | |
| D�� | ��ѧ�仯һ�������������� |
 ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������
ij����ֻ��C��H��O����Ԫ�أ������ģ����ͼ��ʾ�������й���12��ԭ�ӣ�ͼ��������֮������ߴ���������˫���Ȼ�ѧ������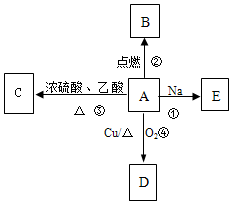 A��������ˮ���л���C2H5OH���ܷ�����ͼ��ʾ�Ķ��ַ�Ӧ�����ֲ������ԣ���D����Է�������Ϊ44������ʽΪC2H4O����ش��������⣺
A��������ˮ���л���C2H5OH���ܷ�����ͼ��ʾ�Ķ��ַ�Ӧ�����ֲ������ԣ���D����Է�������Ϊ44������ʽΪC2H4O����ش��������⣺