题目内容
17.下列反应的离子方程式正确的是( )①铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
②往FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+
③氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O
④氯化铁水解:Fe3++3H2O═Fe(OH)3↓+3H+
⑤氯化亚铁溶液中加入氯水:Fe2++C12═Fe3++2C1-
⑥碳酸氢钠水解:HCO3-+H2O═H3O++CO32-
⑦通入过量二氧化硫于碳酸氢钠溶液:SO2+HCO3-═CO2+HSO3-
⑧氯气通入氢氧化钠溶液:2OH-+C12═C1-+C1O-+H2O.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②④⑤ | D. | ②⑦⑧ |
分析 ①铁和稀硫酸反应生成的是亚铁离子,不是铁离子;
②往FeCl3溶液中加入Fe粉生成氯化亚铁;
③氧化亚铁溶于稀硝酸,亚铁离子被氧化成铁离子;
④氯化铁水解生成的是氢氧化铁胶体,不能使用沉淀符号,且为可逆反应;
⑤离子方程式两边正电荷不相等,违反了电荷守恒;
⑥碳酸氢钠水解生成碳酸和氢氧根离子;
⑦通入过量二氧化硫于碳酸氢钠溶液,反应生成二氧化碳和亚硫酸氢根离子;
⑧氯气通入氢氧化钠溶液生成氯化钠、次氯酸钠和水.
解答 解:①铁和稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故①错误;
②往FeCl3溶液中加入Fe粉,反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe═3Fe2+,故②正确;
③氧化亚铁溶于稀硝酸,反应生成硝酸铁和水,正确的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,故③错误;
④氯化铁水解程度较小,氢氧化铁不能使用沉淀符号,正确的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故④错误;
⑤氯化亚铁溶液中加入氯水,反应生成氯化铁,正确的离子方程式为:2Fe2++C12═2Fe3++2C1-,故⑤错误;
⑥碳酸氢钠水解生成碳酸和氢氧根离子,正确的离子方程式为:HCO3-+H2O?H2CO3+OH-,故⑥错误;
⑦通入过量二氧化硫于碳酸氢钠溶液,反应生成亚硫酸氢根离子和二氧化碳,反应的离子方程式为:SO2+HCO3-═CO2+HSO3-,故⑦正确;
⑧氯气通入氢氧化钠溶液,反应的离子方程式为:2OH-+C12═C1-+C1O-+H2O,故⑧正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
(2)最高价氧化物的水化物碱性最强的是KOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF,
(4)在这些元素中(除I外),原子半径最大的是K,原子半径最小的是F
(5)D和K组成化合物的电子式
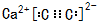 ,
,(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+2H2O.
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |
(1)25℃时,用合成气制备甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(l)△H=-128.1kJ?mol-1.
(2)工业上可利用甲烷制造合成气,发生的反应为CH4(g)+CO2(g)?2CO(g)+2H2(g);某温度下,向容积为4L的恒容密闭容器中通入6mol CO2和6mol CH4发生上述反应,5min后在该温度下达到平衡,这时测得反应体系中各组分的体积分数相等,则该反应在0~5min内的平均反应速率v(CO)=0.2mol?L-1?min-1;在相同温度下,将上述反应改在起始容积为4L的恒压密闭容器内进行,则到达平衡的时间大于(填“大于”或“小于”或“等于”)5min.
(3)反应CH3OH(g)+CO(g)?HCOOCH3(g)△H=-29.1kJ?mol-1为一碳化学在有机合成方面的重要应用.温度和压强对该反应的影响如图所示:

①根据反应体系的压强对甲醇转化率的影响并综合考虑生产成本因素,在下列各压强数据中,工业上制取甲酸(HCOOCH3)甲酯应选择的压强是b(填下列序号字母);
a.3.5×106Pa b.4.0×106 Pa c.5.0×106 Pa
②用上述方法制取甲酸甲酯的实际工业生产中,采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,又因反应放热,升高温度时平衡逆向移动,转化率降低.
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定伴随物质的状态变化 | |
| D. | 化学变化一定有新物质生成 |
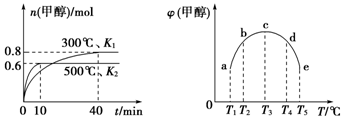
| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 molCH3COOK含有3×6.02×1023个氢元素 |