题目内容
2.FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:(1)FeCl3 净水的原理是Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质.FeCl3 溶液腐蚀钢铁设备的主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3.
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol•L-1,c(Fe3+)=1.0×10-3mol•L-1,c(Cl-)=5.3×10-2mol•L-1,则该溶液的c(H+)约为1.0×10-2mol•L-1.
②完成NaClO3 氧化FeCl2 的离子方程式:1ClO3-+6Fe2++6H+=1Cl-+6Fe3++3H2O.
分析 (1)FeCl3能水解生成胶体,胶体能吸附水中的悬浮物;FeCl3与Cu反应生成氯化亚铁和氯化铜;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,结合电荷守恒、质量守恒配平.
解答 解:(1)FeCl3在水中水解产生氢氧化铁胶体,胶体能吸附水中的悬浮物,所以FeCl3 能净水;FeCl3与Cu反应生成氯化亚铁和氯化铜,其反应的离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2 Fe3++Fe=3 Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,
故答案为:1.0×10-2mol•L-1;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:1; 6; 6H+;1;6;3H2O.
点评 本题综合考查铁的化合物性质的应用,为高频考点,侧重考查学生的分析能力和计算能力,题目涉及氧化还原反应方程式的配平、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.

| A. | 该反应的化学方程式为:CO2+H2 $?_{高温}^{催化剂}$ CO+H2O | |
| B. | 恒温恒容下,增大压强,H2 浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的反应热为负值 |
| A. | 该溶液的pH<7 | B. | CN-的水解程度大于HCN的电离程度 | ||
| C. | c(CN-)+c(HCN)=0.02 mol•L-1 | D. | c(CN-)+c(OH-)=0.01 mol•L-1+c(H+) |
| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
| A. | 二氧化碳、BaSO4 | B. | 盐酸、蔗糖 | C. | KNO3、乙醇 | D. | NaOH、液氯 |
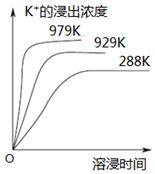 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
| A. | 碳酸钙受热分解 | B. | 食物氧化腐败 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 酸与碱的中和反应 |