题目内容
15.某溶液中含有SO42-、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1:2:4,则离子M可能是( )| A. | H+ | B. | K+ | C. | Cl- | D. | Ba2+ |
分析 根据溶液中正电荷总数等于负电荷总数计算M的电荷,然后结合离子反应发生条件判断.
解答 解:某溶液中含有SO42-、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1:2:4,正电荷总数为:4×1=4,负电荷总数为:2×1+2×2=6,则M带正电荷,由于H+与CO32-不能共存,Ba2+与SO42-、CO32-不能共存,
所以M只能是K+,
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
5.下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成CO2和H2O都是恒量的是( )
| A. | C3H6 C2H4 | B. | C2H4 C2H6 | C. | C3H8 C3H6 | D. | C6H6 C2H2 |
3.2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
| A. | 世博会期间,处理废水时加入明矾可作为混凝剂以吸附水中的悬浮物杂质且有杀菌消毒的作用 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博会中国馆--“东方之冠”使用了大量钢筋混凝土,混凝土是混合物 | |
| D. | 世博停车场安装光电设施,可将阳光转化为电能以供应照明 |
20.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.
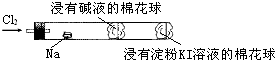
实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )

实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 |
4.下列离子方程式书写正确的是( )
| A. | 大理石和稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氧化铝和氢氧化钠溶液反应:Al2O3+OH-═AlO2-+H2O | |
| D. | 稀硝酸溶液中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
 B.乙烯
B.乙烯
 2NH3
2NH3