题目内容
4.下列离子方程式书写正确的是( )| A. | 大理石和稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氧化铝和氢氧化钠溶液反应:Al2O3+OH-═AlO2-+H2O | |
| D. | 稀硝酸溶液中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
分析 A.碳酸钙为沉淀,应保留化学式;
B.二者反应生成氢氧化钠和氢气;
C.原子个数不守恒;
D.不符合反应客观事实.
解答 解:A.大理石和稀盐酸反应,离子方程式:2H++CaCO3═CO2↑+H2O+Ca2+,故A错误;
B.金属钠投入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B正确;
C.氧化铝和氢氧化钠溶液反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故C错误;
D.稀硝酸溶液中加入过量铁粉生成二价铁离子,离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,为高考频考点,明确物质的性质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.某溶液中含有SO42-、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1:2:4,则离子M可能是( )
| A. | H+ | B. | K+ | C. | Cl- | D. | Ba2+ |
12.碳酸氢铵、硫酸铵均是我国主要的氮肥品种,碳酸氢铵在贮存和运输过程中容易挥发损失.为了鉴定其质量和确定田间施用量,必须测定其含氮量.
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量.
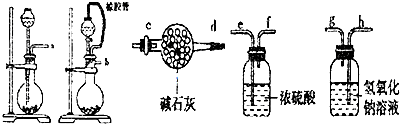
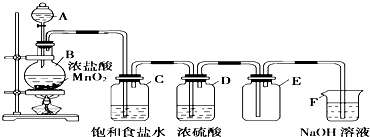
(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为b-e-f-h-g-c 组装好装置,连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
(2)检验气密性后,将样品放入圆底烧瓶中,滴加液体.该液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化纳
II.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量.步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧化钠标准溶液滴定至终点.再重复滴定2次,三次滴定的读数如下表:
计算出该样品中的氮的质量分数为14%.
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填”偏大“偏小”或“无影响”).
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理否(填“是”或“否”),理由是因为用甲醛法制的碳酸不稳定,不适合中和滴定.
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量.

(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为b-e-f-h-g-c 组装好装置,连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
(2)检验气密性后,将样品放入圆底烧瓶中,滴加液体.该液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化纳
II.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量.步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧化钠标准溶液滴定至终点.再重复滴定2次,三次滴定的读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填”偏大“偏小”或“无影响”).
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理否(填“是”或“否”),理由是因为用甲醛法制的碳酸不稳定,不适合中和滴定.
9.下列离子反应不正确的是( )
| A. | FeCl2溶液中通入Cl2:2 Fe2++Cl2=2 Fe3++2Cl- | |
| B. | Al2O3与NaOH溶液反应:Al2O3+2OH-=2 AlO2-+H2O | |
| C. | FeCl3溶液与铜:Fe3++Cu=Fe2++Cu2+ | |
| D. | Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- |
13.用NA标示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.5molH2O的分子数为1.5NA | B. | 0.5molNaCl的原子数为1 NA | ||
| C. | 28gCO的分子数为1 NA | D. | 32gO2的原子数为1 NA |
14.下列有机物经催化加氢后不能生成2-甲基戊烷的是( )
| A. | CH2═C(CH3)CH2CH2CH3 | B. | CH3C(CH3)═CHCH2CH3 | ||
| C. | CH2═CHCH(CH3)CH2CH3 | D. | CH3CH=CHCH(CH3)CH3 |
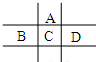 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: