题目内容
某温度下,Kw=1×10-13.该温度下,将pH=a,体积为Vx的H2SO4与pH=b,体积为Vy的NaOH混合.
(1)若混合后溶液呈中性.①如果Vx=Vy,则a+b= ,②若a+b=11,则Vx:Vy= .
(2)若混合后溶液的pH=3,且a=2、b=10,则Vx:Vy= .
(3)将pH=a,体积为Vx的CH3COOH和H2SO4分别加m mL和n mL水稀释,稀释后的pH均为a+2,则m n.(填“>”、“<”或“=”)
(1)若混合后溶液呈中性.①如果Vx=Vy,则a+b=
(2)若混合后溶液的pH=3,且a=2、b=10,则Vx:Vy=
(3)将pH=a,体积为Vx的CH3COOH和H2SO4分别加m mL和n mL水稀释,稀释后的pH均为a+2,则m
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)若混合后溶液呈中性,硫酸电离出的氢离子与氢氧化钠电离产生的氢氧根离子的物质的量相等,由此分析解答;
(2)若混合后溶液的pH=3,说明两者混合后酸过量,混合后氢离子的浓度为10-3mol/L;
(3)醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而硫酸是强电解质,不存在电离平衡,据此分析.
(2)若混合后溶液的pH=3,说明两者混合后酸过量,混合后氢离子的浓度为10-3mol/L;
(3)醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而硫酸是强电解质,不存在电离平衡,据此分析.
解答:
解:(1)①若混合后溶液呈中性,氢离子的物质的量等于氢氧根离子的物质的量,即10-a×Vx=10b-13×Vy,又因为Vx=Vy,所以a+b=13;②若a+b=11,则Vx:Vy=10a+b-13,a+b=11,则Vx:Vy=10-2,故答案为:13;10-2;
(2)若混合后溶液的pH=3,说明两者混合后酸过量,混合后氢离子的浓度为
=10-3,解得Vx:Vy=2:9,故答案为:2:9;
(3)因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中氢离子的物质的量增大,而硫酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则醋酸的体积比硫酸的体积要大,就必须使m>n,故答案为:>.
(2)若混合后溶液的pH=3,说明两者混合后酸过量,混合后氢离子的浓度为
| 10-2×Vx-10-3×VY |
| Vx+VY |
(3)因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中氢离子的物质的量增大,而硫酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则醋酸的体积比硫酸的体积要大,就必须使m>n,故答案为:>.
点评:本题考查了酸碱混合和稀释对强弱电解质的不同影响,加水稀释,弱电解质的电离平衡会向右移动,题目难度不大.

练习册系列答案
相关题目
将标准状况下,将22.4L NH3气体溶于83mL水中,所得溶液密度为0.88g/cm3,则此溶液的物质的量浓度(mol/L)为( )
| A、8.0 mol/L |
| B、8.8 mol/L |
| C、9.0 mol/L |
| D、9.2 mol/L |
下列哪一组溶液的反应可用H++OH-=H2O 表示( )
| A、硫酸和氢氧化钡 |
| B、硫酸和烧碱 |
| C、硫酸和氢氧化铜 |
| D、硫酸和氨水 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
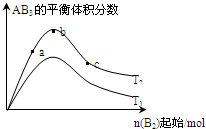

| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |
下面是常用来快速制备氨气的装置和试剂,其中不合理的是( )


| A、一种 | B、二种 | C、三种 | D、四种 |
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)