题目内容
将标准状况下,将22.4L NH3气体溶于83mL水中,所得溶液密度为0.88g/cm3,则此溶液的物质的量浓度(mol/L)为( )
| A、8.0 mol/L |
| B、8.8 mol/L |
| C、9.0 mol/L |
| D、9.2 mol/L |
考点:物质的量浓度的相关计算
专题:
分析:根据n=
计算氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液质量分数,再根据c=
计算溶液物质的量浓度.
| V |
| Vm |
| 1000ρω |
| M |
解答:
解:标准状况下,将22.4L NH3气体的物质的量为
=1mol,氨气的质量为1mol×17g/mol=17g,83mL水的质量为83mL×1g/mL=83g,故溶液质量分数为
=17%,所得溶液密度为0.88g/cm3,则此溶液的物质的量浓度为
mol/L=8.8mol/L,故选B.
| 22.4L |
| 22.4L/mol |
| 17g |
| 17g+83g |
| 1000×0.88×17% |
| 17 |
点评:本题考查物质的量浓度有关计算,难度不大,可以利用定义式进行计算,注意理解物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
下列有关生活常识的说法中,正确的是( )
| A、用完后的废电池应该集中回收处理 |
| B、天然果汁中不含任何化学物质 |
| C、“绿色食品”指颜色为绿色的食品 |
| D、“白色污染”是白色粉尘造成的污染 |
下列对进行焰色反应的实验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰呈原色时,再蘸被检验物质
③每次实验后都要将铂丝蘸稀硫酸后灼烧至火焰呈无色为止
④没有铂丝可用无锈铁丝代替.
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰呈原色时,再蘸被检验物质
③每次实验后都要将铂丝蘸稀硫酸后灼烧至火焰呈无色为止
④没有铂丝可用无锈铁丝代替.
| A、仅③不正确 |
| B、仅④不正确 |
| C、③④不正确 |
| D、②③④不正确 |
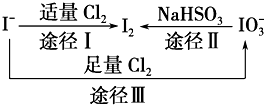 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
某温度下,V mL不饱和NaNO3溶液a g,蒸发掉b g水或加入b g NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
| A、该温度下NaNO3的溶解度为200 g | ||
B、原不饱和溶液中NaNO3的质量分数为
| ||
C、原不饱和溶液中NaNO3的物质的量浓度为
| ||
D、原不饱和溶液的密度为
|
下列措施对水的电离无影响的是( )
| A、升高温度 | B、加入稀醋酸 |
| C、加入醋酸钠 | D、加入食盐 |