题目内容
25℃时某KCN溶液的pH=12,则可知该溶液中水电离出的c(OH-)= mol?L-1.
考点:盐类水解的原理,水的电离
专题:
分析:25℃时某KCN溶液的pH=12,说明KCN是强碱弱酸盐,CN-离子水解导致溶液呈碱性,水电离出的c(OH-)=
,据此分析解答.
| Kw |
| c(H+) |
解答:
解:25℃时某KCN溶液的pH=12,说明KCN是强碱弱酸盐,溶液中c(H+)=10-12 mol/L,CN-离子水解导致溶液呈碱性,水电离出的c(OH-)=
=
mol/L=0.01mol/L,故答案为:0.01.
| Kw |
| c(H+) |
| 10-14 |
| 10-12 |
点评:本题以盐类水解为载体考查水的电离,明确盐溶液呈碱性的原因是解本题关键,会根据离子积常数及溶液pH进行有关计算,同时考查分析、计算能力,也应该会计算酸或碱溶液中水的电离,题目难度不大.

练习册系列答案
相关题目
若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B、将49gH2SO4溶于1L水中,所得溶液的物质的量浓度为0.5mol?L-1 |
| C、标准状况下,11.2L水所含的分子数为0.5NA |
| D、18g NH4+含有的电子数为10NA |
 如图,按照图片中的化学式,推导出单体.
如图,按照图片中的化学式,推导出单体.
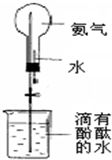 (1)写出实验室制取氨气的化学方程式:
(1)写出实验室制取氨气的化学方程式: