题目内容
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)(1)已知在25℃时:
①C(石墨)+
| 1 |
| 2 |
②C(石墨)+O2(g)=CO2(g)△H2=-394kJ?mol-1
③H2(g)+
| 1 |
| 2 |
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H=
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验Ⅰ中,从反应开始到反应达到平衡时,CO的平均反应速率v(CO)=
③实验Ⅱ条件下反应的平衡常数K=
若某温度T时,该反应的平衡常数为0.5,则T
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时v(正)
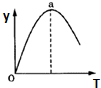
⑥若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是
A.CO2的百分含量
B.混合气体的平均相对分子质量
C.CO的转化率
D.H2O的物质的量.
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据化学平衡标志分析判断,正逆反应速率相同,个组分含量不变;
②反应速率=
计算;
③平衡常数K=
;依据反应是放热反应结合平衡常数随温度变化分析判断;
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,反应比相同所以起始量一氧化碳小于水;
⑤计算浓度商和平衡常数比较分析判断反应进行的方向;
⑥依据化学平衡特征和平衡移动原理分析随温度升高,先增大后减小,说明增大为反应进行未达到平衡,a点后Y减小说明升温平衡向减小Y的方向进行;
(2)①依据化学平衡标志分析判断,正逆反应速率相同,个组分含量不变;
②反应速率=
| △c |
| △t |
③平衡常数K=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
④实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,反应比相同所以起始量一氧化碳小于水;
⑤计算浓度商和平衡常数比较分析判断反应进行的方向;
⑥依据化学平衡特征和平衡移动原理分析随温度升高,先增大后减小,说明增大为反应进行未达到平衡,a点后Y减小说明升温平衡向减小Y的方向进行;
解答:
解:(1)①C(石墨)+
O2(g)=CO(g)△H1=-111kJ?mol-1
②C(石墨)+O2(g)=CO2(g)△H2=-394kJ?mol-1
③H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
依据盖斯定律②-③-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ?mol-1;
故答案为:-41kJ?mol-1 ;
(2)①对于反应CO(g)+H2O(g)?CO2(g)+H2(g),
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态,故A正确
B.气体质量和体积不变,混合气体的密度始终不改变,不能说明该反应已达化学平衡状态,故B错误;
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,反应前后气体体积不变,相当于增大压强,平衡不移动,H2的体积分数不变,故C错误;
D.若使用催化剂,改变反应速率不改变化学平衡,会改变反应的途径,但反应的焓变不变,故D正确
故答案为:AD;
②实验Ⅰ中,从反应开始到反应达到平衡时,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
CO的平均反应速率v(CO)=
=0.16mol?L-1?min-1 ;
故答案为:0.16mol?L-1?min-1 ;
③CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 2 1 0 0
变化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 1.5 0.5 0.5 0.5
反应前后气体体积不变,可以用物质的量代替平衡浓度计算平衡常数;
K=
=0.33;
若某温度T时,该反应的平衡常数为0.5,反应是放热反应,平衡常数增大,说明是降低温度,T<900°C;
故答案为:0.33,<;
④实验Ⅲ中,一氧化碳和和水蒸气反应比相同,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
故答案为:a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,浓度商Q=
=0.2<K,
则此时v(正)>v(逆),平衡正向进行;
故答案为:>,正反应;
⑥CO(g)+H2O(g)?CO2(g)+H2(g)反应是放热反应,随温度升高,先增大后减小,说明增大为反应进行未达到平衡,a点后Y减小说明升温平衡向减小Y的方向进行,若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是
A.CO2的百分含量,开始随反应增大,达到平衡升温平衡逆向进行二氧化碳减小,故A符合;
B.反应前后气体质量和物质的量不变,混合气体的平均相对分子质量始终不变,故B不符合;
C.CO的转化率开始随反应增大,达到平衡升温平衡逆向进行,一氧化碳转化率减小,故C符合;
D.H2O的物质的量先减小平衡后,随温度升高平衡逆向进行,水的量增大,故D不符合;
故答案为:AC;
| 1 |
| 2 |
②C(石墨)+O2(g)=CO2(g)△H2=-394kJ?mol-1
③H2(g)+
| 1 |
| 2 |
依据盖斯定律②-③-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ?mol-1;
故答案为:-41kJ?mol-1 ;
(2)①对于反应CO(g)+H2O(g)?CO2(g)+H2(g),
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态,故A正确
B.气体质量和体积不变,混合气体的密度始终不改变,不能说明该反应已达化学平衡状态,故B错误;
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,反应前后气体体积不变,相当于增大压强,平衡不移动,H2的体积分数不变,故C错误;
D.若使用催化剂,改变反应速率不改变化学平衡,会改变反应的途径,但反应的焓变不变,故D正确
故答案为:AD;
②实验Ⅰ中,从反应开始到反应达到平衡时,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
变化量(mol) 1.6 1.6 1.6 1.6
平衡量(mol) 2.4 0.4 1.6 1.6
CO的平均反应速率v(CO)=
| ||
| 5min |
故答案为:0.16mol?L-1?min-1 ;
③CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 2 1 0 0
变化量(mol) 0.5 0.5 0.5 0.5
平衡量(mol) 1.5 0.5 0.5 0.5
反应前后气体体积不变,可以用物质的量代替平衡浓度计算平衡常数;
K=
| 0.5×0.5 |
| 1.5×0.5 |
若某温度T时,该反应的平衡常数为0.5,反应是放热反应,平衡常数增大,说明是降低温度,T<900°C;
故答案为:0.33,<;
④实验Ⅲ中,一氧化碳和和水蒸气反应比相同,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是a<b;
故答案为:a<b;
⑤若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,浓度商Q=
| 0.2×0.5 |
| 1×0.5 |
则此时v(正)>v(逆),平衡正向进行;
故答案为:>,正反应;
⑥CO(g)+H2O(g)?CO2(g)+H2(g)反应是放热反应,随温度升高,先增大后减小,说明增大为反应进行未达到平衡,a点后Y减小说明升温平衡向减小Y的方向进行,若仅改变温度,纵坐标y随T变化如图所示,则纵坐标y表示的是
A.CO2的百分含量,开始随反应增大,达到平衡升温平衡逆向进行二氧化碳减小,故A符合;
B.反应前后气体质量和物质的量不变,混合气体的平均相对分子质量始终不变,故B不符合;
C.CO的转化率开始随反应增大,达到平衡升温平衡逆向进行,一氧化碳转化率减小,故C符合;
D.H2O的物质的量先减小平衡后,随温度升高平衡逆向进行,水的量增大,故D不符合;
故答案为:AC;
点评:本题考查了化学平衡的分析计算,主要是影响平衡因素,平衡常数、转化率概念计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B、将49gH2SO4溶于1L水中,所得溶液的物质的量浓度为0.5mol?L-1 |
| C、标准状况下,11.2L水所含的分子数为0.5NA |
| D、18g NH4+含有的电子数为10NA |
在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
| A、Na+ |
| B、Al3+ |
| C、Fe2+ |
| D、Fe3+ |
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |
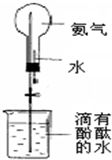 (1)写出实验室制取氨气的化学方程式:
(1)写出实验室制取氨气的化学方程式: