题目内容
15.工业上用DME法以H2和CO为原料生产甲醚(CH3OCH3).其原理是在同一容器中发生如下两个连续反应:①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
分析 A.CO的转化率随温度升高而降低,说明升高温度反应①平衡逆向移动,甲醚的产率开始随温度升高而增大,说明升高温度反应②向正反应移动;
B.反应②为吸热反应,升高温度平衡正向移动,温度越高平衡常数越大;
C.比较反应速率大小应处于同一反应体系;
D.增大压强,不影响反应②的平衡移动,但反应①向正反应移动,甲醇浓度增大,使反应②正向移动.
解答 解:A.从图表数据可知:CO的转化率随温度升高而降低,说明升高温度反应①平衡逆向移动,正反应为放热反应,甲醚的产率开始随温度升高而增大,说明升高温度反应②向正反应移动,正反应为吸热反应,故A错误;
B.反应②为吸热反应,升高温度平衡正向移动,温度越高平衡常数越大,所以290℃时反应②平衡常数值不是最大,温度高时甲醚产率减小,是因为反应①逆向移动,甲醇浓度减小所致,①起主导作用,故B错误;
C.甲醇处于2个不同的反应体系,不能确定反应速率问题,故C错误;
D.增大压强,虽然不影响反应②的平衡移动,反应①为气体体积减小的反应,增大压强平衡正向移动,甲醇的浓度增大,使反应②正向移动,增大CH3OCH3产率,故D正确;
故选:D.
点评 本题考查化学平衡计算与影响因素,注意容器内2个关联的平衡体系相互影响,侧重考查学生分析能力,题目难度中等.

练习册系列答案
相关题目
12.下列化学药品与其危险化学品图形标志不一致的是( )
| A. |  活性炭 | B. |  天然气 | C. |  酒精 | D. |  白磷 |
20.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)△H<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
4.根据下列实验操作和现象所得结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
5.下列反应可能属于吸热反应的是( )
| A. | 甲烷与氧气反应 | B. | 碳酸钙分解反应 | C. | KOH与稀硫酸反应 | D. | 铁丝与氯气反应 |
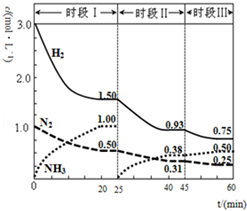 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.