题目内容
3.下图是一种工业制取纯碱的生产流程简图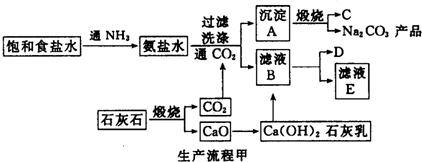
(1)流程甲中先通NH3后通CO2的原因是氨气在水中溶解度大,先通氨气,可以吸收更多的二氧化碳,提高生成HCO3-的浓度,有利于促进更多的NaHCO3析出.
(2)生成沉淀A的化学方程式为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;将石灰乳加入滤液B中发生反应的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
(3)流程甲中可循环利用的物质的名称为二氧化碳和氨气.
某化工厂对流程甲进行了如下图所示的改进.

(4)流程乙中可以循环利用物质的化学式为CO2、NaCl;和流程甲相比,流程乙的优点是提高氯化钠的利用率、同时得到NH4Cl可作氮肥、减少环境污染.
(5)不用其它试剂,检查乙流程中副产品F是否纯净的操作是取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净.
(6)在乙流程中,若使用11.7吨食盐,最终得到10.07吨纯碱,则NaCl的利用率为95.0%.
分析 制取纯碱的流程:向饱和的氯化钠溶液中依次通入氨气,得到氨盐水,碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,二氧化碳通入到氨盐水中,发生反应:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,析出碳酸氢钠晶体(沉淀A),加热碳酸氢钠晶体可制得纯碱和二氧化碳(物质C),滤液B中加入氢氧化钙,发生反应Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,得到氨气(D),滤液为氯化钙,对流程甲进行改进,原料为合成氨厂的废气,NH4Cl 在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在278K~283K(5℃~10℃)时,向滤液B中加入食盐细粉,而使NH4Cl (F)单独结晶析出供做氮肥,滤液为氯化钠.
(1)氨气在水中的溶解性大,二氧化碳溶解性小,如果先通二氧化碳,后通氨气,则溶液中的碳酸根就会很小
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵;氢氧化钙和氯化铵反应生成氯化钙、氨气、水;
(3)煅烧炉内分解的是碳酸氢钠,产物为CO2和水,而沉淀池中需要通入的气体为CO2;滤液中含有的氯化铵与碱作用得到的氨气也能循环利用;
(4)对流程甲进行改进,原料为合成氨厂的废气,滤液氯化钠,可循环使用;
(5)F为氯化铵,根据其受热易分解的性质验证,氯化铵分解生成氨气和氯化氢;
(6)根据反应方程式,由氯化钠与纯碱的相对质量计算氯化钠充分利用时生成的纯碱的质量,再根据实际生成纯碱计算氯化钠的利用率.
解答 解:(1)二氧化碳在水中的溶解性小,NH3在NaCl溶液中溶解度很大,CO2在氨化的溶液中溶解度大,先通氨气,可以吸收更多的二氧化碳,提高生成HCO3-的浓度,有利于促进更多的NaHCO3析出,反应原理为,NH3+CO2+H2O═NH4HCO3,NaCl+NH4HCO3═NaHCO3↓+NH4Cl,
故答案为:氨气在水中溶解度大,先通氨气,可以吸收更多的二氧化碳,提高生成HCO3-的浓度,有利于促进更多的NaHCO3析出;
(2)沉淀池中,饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,石灰乳为氢氧化钙,滤液B为氯化铵溶液,将石灰乳加入滤液B中发生反应的化学方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,
故答案为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
(3)碳酸氢钠受热分解生成碳酸钠、CO2和水,可将CO2通入沉淀中循环利用,故X为CO2,母液中铵根离子与碱作用得到的氨气也能循环利用,
故答案为:二氧化碳和氨气;
(4)反应需要二氧化碳和氯化钠,生成的碳酸氢钠受热分解得碳酸钠、二氧化碳(C),二氧化碳可循环使用,向滤液B加入食盐细粉,而使NH4Cl 结晶析出,并得滤液氯化钠,可循环使用;F为NH4Cl,和流程甲相比,流程乙提高氯化钠的利用率、同时得到NH4Cl可作氮肥、减少环境污染,
故答案为:CO2,NaCl (2分) 提高氯化钠的利用率、同时得到NH4Cl可作氮肥、减少环境污染;
(5)氯化铵分解生成氨气和氯化氢,F为NH4Cl,氯化铵受热易分解,取少量氯化铵产品于试管底部,加热,若分解完全,试管底部无残留物,即产品全为氯化铵,
故答案为:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净;
(6)根据化学方程式,氯化钠与纯碱满足2NaCl~Na2CO3
2×58.5 106
11.7t 10.6t,即氯化钠充分利用时生成纯碱10.6t,而实际生成纯碱10.07t,氯化钠的利用率为:$\frac{10.07}{10.6}$×100%=95%.
故答案为:95.0%.
点评 本题考查纯碱制备,为高频考点,把握制备工业流程、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意物质的循环使用,题目难度中等.

| A. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 | |
| B. | 钢管与电源正极连接,钢管可被保护 | |
| C. | 钢管与铜管露天堆放在一起时,钢管不易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应式:2H+-2e-=H2↑ |
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g•L-1) | 2×10-2 | 4.303×10-2 | 18 |
| A. | 含Ca(H2PO4)2的磷肥可以与草木灰混施 | |
| B. | Ksp[CaHPO4]=c(Ca2+)•c(H+)•c(PO43-) | |
| C. | 20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol•L-1 | |
| D. | 向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
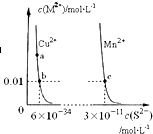
| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
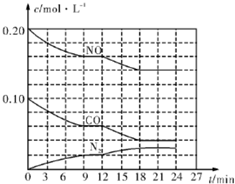 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.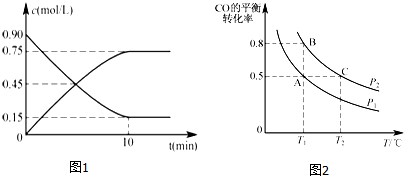 甲醇是一种重要的可再生能源.
甲醇是一种重要的可再生能源.