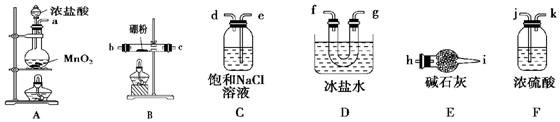
题目内容
10.在一定温度下,将3mol A和2mol B充入到2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)?x C(g)+D(l),2min末反应达到平衡状态,此时C(A):C(B):C(C)=1:2:4.由此推断:(1)x值等于3.
(2)A的转化率为80%.
(3)以C表示的反应速率为0.6 mol/(L•min).
(4)平衡后与开始时气体压强的最简整数比为21:25.
(5)在达到平衡的过程中,气体的密度一直减小(填增大、减小、不变或无法判断).
分析 1、化学平衡计算的一般思路和方法:有关化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等.通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的关系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”.
2、化学反应速率v=$\frac{△c}{△t}$.
解答 (1)设2min内参与反应的B的物质的量为ymol,
3A(g)+B(g)?x C(g)+D(l),
开始(mol):3 2
反应(mol):3y y xy
平衡(mol):3-3y 2-y xy
由题意知:$\frac{3-3y}{2-y}$=$\frac{1}{2}$,解得y=0.8,由$\frac{2-0.8}{0.8x}$=$\frac{2}{4}$解得x=3;
故答案为:3;
(2)由(1)中计算可知,反应的A的物质的量为2.4mol,所以α=$\frac{2.4mol}{3mol}$×100%=80%
故答案为:80%;
(3)平衡时C的浓度c(C)=$\frac{2.4mol}{2L}$=1.2mol•L-1,所以以C表示的反应速率v=$\frac{△c(C)}{△t}$=$\frac{1.2mol•L-1}{2min}$=0.6 mol/(L•min);
故答案为:0.6 mol/(L•min)或0.01 mol/(L•s);
(4)平衡后气体的总物质的量为:0.6mol+1.2mol+2.4mol=4.2mol,开始时气体的总物质的量为5mol,所以平衡后与开始时气体压强的最简整数比为21:25
故答案为:21:25;
(5)在达到平衡的过程中,因为有液体生成,气体的总量减少,密闭容器的体积不变,所以气体的密度减小.
故答案为:减小.
点评 本题主要考察化学平衡、化学反应速率以及转化率等计算,题目综合性强,但知识点比较基础,稍有难度.

| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | B. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | C. | c(H+)•c(OH-) | D. | OH-的物质的量 |
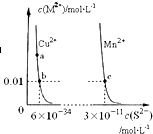
| A. | a点对应的 Ksp大于b点对应的Ksp | |
| B. | 向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)═CuS(s)+Mn2+(aq) | |
| C. | 在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=2×10-23:1 | |
| D. | 该温度下,Ksp(CuS)小于Ksp(MnS) |
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
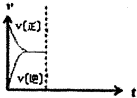
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
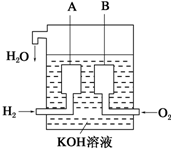 (1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题:
(1)对于反应:K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,回答下列问题: