题目内容
4.根据下列实验操作和现象所得结论正确的是( )| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸根离子结合氢离子能力越强,其酸的酸性越弱;
B.原溶液中可能含有Fe3+;
C.氧化还原反应中氧化剂的氧化性大于氧化产物;
D.浓硫酸与乙醇共热可能生成乙烯和二氧化硫.
解答 解:A.室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊,说明HSO3-的酸性大于苯酚,所以C6H5O-结合质子的能力比SO32-强,故A正确;
B.原溶液中可能含有Fe3+,检验Fe2+的方法是:向待测液X中滴入KSCN溶液,无现象,再滴入氯水,溶液变红,说明待测液X中一定含有Fe2+,故B错误;
C.向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色,S2O82-是氧化剂,MnO4-是氧化产物,氧化还原反应中氧化剂的氧化性大于氧化产物,则S2O82-氧化性比MnO4-强,故C正确;
D.浓硫酸与乙醇共热可能生成乙烯和二氧化硫,二氧化硫也能使酸性KMnO4溶液,所以气体Y为乙烯和二氧化硫,故D错误;
故选AC.
点评 本题考查化学实验方案评价,题目难道中等,涉及离子检验、酸性强弱比较、氧化性比较、物质鉴别等知识点,明确实验原理及物质性质差异性是解本题关键.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
15.工业上用DME法以H2和CO为原料生产甲醚(CH3OCH3).其原理是在同一容器中发生如下两个连续反应:
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
19. 已知三个反应如下:
已知三个反应如下:
Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
(1)K1的表达式为$\frac{c({H}_{2})}{c({H}_{2}O)}$:根据反应I、II、III推导出K1、K2、K3的关系式K3=_$\frac{{K}_{1}}{{K}_{2}}$.
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
④反应在2min内的平均速率为v(H2O)=0.075mol/(L.min);
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
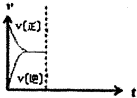
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
 已知三个反应如下:
已知三个反应如下:Fe(s)+H2O(g)?FeO(s)+H2(g)△H1平衡常数为K1;
CO(g)+H2O(g)?H2(s)+CO2(g)△H2平衡常数为K2;
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3平衡常数为K3;
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700℃ | 800℃ |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 |
(2)要使反应I在一定条件下建立的平衡右移,可采取的措施有CE.(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少Fe0的量
(3)已知反应II在800℃可以自发进行,则△H2>0(填“>”、“<”或“=”),由以上信息推断反应III正反应方向为放热反应.(填“吸热”或“放热”)
(4)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应II,反应在第6min时达到平衡,反应过程中测定的部分数据见表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| N(CO)/mol | 1.20 | 0.90 | 0.80 | |
| N(H2O)/mol | 0.60 | 0.20 |
②800℃时,K2的值为1;
③若反应进行到某一时刻时,混合物中各组分的浓度分别为:c(CO)=0.002mol/L,
c(H2O)=0.003mol/L,c(CO2)=0.0025mol/L,c(H2)=0.0025moUL,则此时反应II中v(正)<v(逆).(填“>”、“<”或“=”)
(5)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应II,当反应达到平衡后,维持温度与压强不变,t1时再通入各l mol的CO和H2O的混合气体,请在图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图.
16.下列措施能明显增大原反应的化学反应速率的是( )
| A. | 恒温恒容条件下,在工业合成氨反应中,增加氮气的量 | |
| B. | 将稀硫酸改为98%的浓硫酸与Zn反应制取H2 | |
| C. | 在H2SO4与NaOH两溶液反应时,增大压强 | |
| D. | Na与水反应时增大水的用量 |
13.下列离子方程式的书写正确的是( )
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
14.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
 甲醇是一种重要的可再生能源.
甲醇是一种重要的可再生能源.