题目内容
能正确表示下列反应的离子方程式的是( )
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.原子不守恒;
B.碳酸氢根离子不能拆开;
C.氢氧化铝不溶于弱碱;
D.铜和稀硝酸反应生成硝酸铜、NO和水.
B.碳酸氢根离子不能拆开;
C.氢氧化铝不溶于弱碱;
D.铜和稀硝酸反应生成硝酸铜、NO和水.
解答:
解:A.原子不守恒,离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,故A错误;
B.碳酸氢根离子不能拆开,离子方程式为HCO3-+H+═CO2↑+H2O,故B错误;
C.氢氧化铝不溶于弱碱,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.铜和稀硝酸反应生成硝酸铜、NO和水,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D正确;
故选D.
B.碳酸氢根离子不能拆开,离子方程式为HCO3-+H+═CO2↑+H2O,故B错误;
C.氢氧化铝不溶于弱碱,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.铜和稀硝酸反应生成硝酸铜、NO和水,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写,明确物质之间发生的反应是解本题关键,再结合离子方程式的书写规则来分析解答,注意:有的化学反应与反应物的量有关,离子方程式书写是学习难点,也是高考高频点,应熟练掌握.

练习册系列答案
相关题目
下列叙述错误的是( )
| A、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B、制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C、用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
下列有关金属的说法正确的是( )
| A、金属原子的核外电子在金属晶体中都是自由电子 |
| B、镁型和铜型的原子堆积方式空间利用率最高 |
| C、金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D、金属导电的实质是金属阳离子在外电场作用下的定向移动 |
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )| A、水是弱电解质 |
| B、可燃冰是可以燃烧的水 |
| C、氢氧两种元素只能组成水 |
| D、0℃时冰的密度比液态水的密度大 |
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 |
| B、再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
| C、溶液中c(OH-)增大 |
| D、醋酸的电离程度增大,c(H+)亦增大 |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A、离子半径的大小顺序为W>Q>Z>X>Y |
| B、元素X的气态氢化物与Q的单质可发生置换反应 |
| C、元素X与Y可以形成5种以上的化合物 |
| D、元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
如图所示,利用海水可提取很多重要的化工原料,下列有关说法不正确的是.( ) 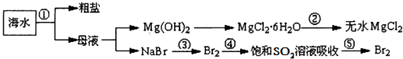

| A、第②步是MgCl2?6H2O在坩埚中加强热分解 |
| B、第①步是海水蒸发浓缩、结晶过滤 |
| C、第③、⑤步可以是通入足量Cl2 |
| D、在第④步反应为:Br2+SO2+2H2O=H2SO4+2HBr |
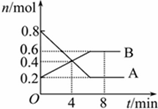 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得: