题目内容
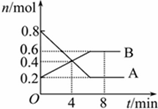 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:(1)该反应的化学方程式为
(2)反应开始至4min时,B的平均反应速率为
(3)平衡时A的转化率为
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法
专题:化学平衡专题
分析:(1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=
计算反应速率;
(3)根据平衡时A物质变化了的物质的量与A物质起始的物质的量之比,可求得A的转化率,根据图象对应的纵坐标判断物质的量浓度以及反应的趋势比较反应速率关系.
(2)根据v=
| △c |
| △t |
(3)根据平衡时A物质变化了的物质的量与A物质起始的物质的量之比,可求得A的转化率,根据图象对应的纵坐标判断物质的量浓度以及反应的趋势比较反应速率关系.
解答:
解:(1)由图象可知,A的物质的量逐渐减小,应为反应物,B的物质的量逐渐增加,应为生成物,参加反应的物质的物质的量之比等于化学计量数之比,
则:n(A):n(B)=(0.8mol-0.2mol):(0.6mol-0.4mol)=3:2,所以反应的化学方程式为:3A 2B,故答案为:3A
2B,故答案为:3A 2B;
2B;
(2)反应开始至4min时,B的平均反应速率为:v=
=
═0.1mol/(L?min),
故答案为:0.1mol/(L?min);
(3)平衡时A的转化率为
×100%=75%;
由图象纵坐标可知:第4min末时A、B的物质的量浓度相等,为
=0.8mol/L,
第4min时,反应继续进行,A的物质的量减小,B的物质的量增加,则反应向正反应方向移动,所以v(正)>v(逆),
第8min时,反应达到平衡状态,反应物的物质的量不再发生变化,此时v(正)=v(逆),
故答案为:75%;>;=.
则:n(A):n(B)=(0.8mol-0.2mol):(0.6mol-0.4mol)=3:2,所以反应的化学方程式为:3A
 2B,故答案为:3A
2B,故答案为:3A 2B;
2B;(2)反应开始至4min时,B的平均反应速率为:v=
| △c |
| △t |
| ||
| 4min |
故答案为:0.1mol/(L?min);
(3)平衡时A的转化率为
| 0.8mol-0.2mol |
| 0.8mol |
由图象纵坐标可知:第4min末时A、B的物质的量浓度相等,为
| 0.4mol |
| 0.5L |
第4min时,反应继续进行,A的物质的量减小,B的物质的量增加,则反应向正反应方向移动,所以v(正)>v(逆),
第8min时,反应达到平衡状态,反应物的物质的量不再发生变化,此时v(正)=v(逆),
故答案为:75%;>;=.
点评:本题考查化学反应速率变化曲线及应用和转化率的计算,题目难度不大,注意分析图象曲线的变化趋势,把握化学平衡状态的特征.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
已知某有机物的结构简式为: ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )
①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
| A、①③④⑤ | B、②③④⑥ |
| C、①③⑤ | D、①②③④⑤⑥ |
当溶液中X
与H2O2分子个数比为2:5时,溶液中X
离子中X元素恰好被还原为较低价态,则X元素的化合价为( )
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
“脚印”、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色反应有关.下列说法错误的是( )
| A、焰色反应一定发生化学变化 |
| B、Na与NaCl在灼烧时火焰颜色相同 |
| C、焰色反应是物质检验的一种实验方法 |
| D、观察K2SO4的焰色应透过蓝色的钴玻璃 |
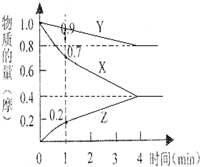 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表: