题目内容
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A、离子半径的大小顺序为W>Q>Z>X>Y |
| B、元素X的气态氢化物与Q的单质可发生置换反应 |
| C、元素X与Y可以形成5种以上的化合物 |
| D、元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;结合原子序数,Q只能为氯元素,据此解答.
解答:
解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,联想NH3极易溶于水,可知X为氮元素,Y为氧元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,说明Z为铝元素,W为硫元素,因为铝在常温下能溶于稀硫酸,在浓硫酸中发生钝化;结合原子序数,Q只能为氯元素,
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->N3->O2->Al3+,即离子半径W>Q>X>Y>Z,故A错误;
B.氯气能与氨气反应得到氮气、HCl(或氯化铵),属于置换反应,故B正确;
C.N元素与O元素可以形成N2O、NO、N2O3、NO2、N2O4、N2O5,故C正确;
D.Al与强碱反应是偏铝酸盐与氢气,硫与强碱反应得到硫化物、亚硫酸盐与水,常温下氯气与碱反应得到氯化物、次氯酸盐及水,故D正确,
故选A.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->N3->O2->Al3+,即离子半径W>Q>X>Y>Z,故A错误;
B.氯气能与氨气反应得到氮气、HCl(或氯化铵),属于置换反应,故B正确;
C.N元素与O元素可以形成N2O、NO、N2O3、NO2、N2O4、N2O5,故C正确;
D.Al与强碱反应是偏铝酸盐与氢气,硫与强碱反应得到硫化物、亚硫酸盐与水,常温下氯气与碱反应得到氯化物、次氯酸盐及水,故D正确,
故选A.
点评:本题结构位置性质关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物性质,B选项为易错点,利用氧化还原反应理解,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
化学与生活密切相关.下列说法不正确的是( )
| A、乙烯可作水果的催熟剂 |
| B、硅胶可作袋装食品的干燥剂 |
| C、福尔马林可作食品的保鲜剂 |
| D、氢氧化铝可作胃酸的中和剂 |
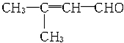 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )