题目内容
13.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )| A. | 可能呈酸性 | B. | 可能呈中性 | C. | 一定呈碱性 | D. | 一定呈中性 |
分析 如果是Na2CO3、Ba(OH)2先混合,再把滤液和H2SO4混合,所得溶液为Na2SO4溶液,溶液显中性;如果是H2SO4、Ba(OH)2先混合,再与Na2CO3混合,得到的是Na2CO3溶液,溶液显碱性,如果是Na2CO3、H2SO4先混合,再把滤液和Ba(OH)2混合,所得溶液为NaOH溶液,呈碱性.
解答 解:若先将Na2CO3溶液和H2SO4溶液混合后,再加Ba(OH)2,Na2CO3、H2SO4恰好完全反应,生成的Na2SO4再与
Ba(OH)2恰好完全反应,最终生成的NaOH溶液显碱性;
若先将Na2CO3溶液和Ba(OH)2溶液混合后,再加H2SO4,Na2CO3、Ba(OH)2恰好完全反应,生成的NaOH再与
H2SO4恰好完全反应,最终生成的Na2SO4溶液显中性;
若先将H2SO4和Ba(OH)2溶液混合后,再加Na2CO3溶液,H2SO4和Ba(OH)2溶液恰好完全反应,生成硫酸钡和水,再加入a2CO3溶液,水解呈碱性.
则混合后溶液可能呈中性或碱性,不可能呈酸性,
故选B.
点评 本题考查酸碱混合的定性判断,题目难度不大,解答本题的关键是把握物质的性质.

练习册系列答案
相关题目
3.常温下,下列叙述正确的是( )
| A. | 1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10ˉ8mol•L-1盐酸的pH=8.0 | |
| D. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
4.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图.下列说法不正确的是( )
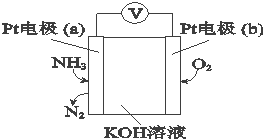

| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为3:4 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
1.2015年11月2日,国产C919大型客机首架机正式下线,其机身采用铝锂合金材料,下列有关合金的说法不正确的是( )
| A. | 钢是用量最大的合金 | |
| B. | 铝锂合金抗腐蚀能力很强,可耐酸碱腐蚀 | |
| C. | 我国在商代就开始使用铜合金 | |
| D. | 铝合金的强度、硬度比纯铝大 |
8.咖啡酸的结构如图所示.关于咖啡酸的描述不正确的是( )


| A. | 分子式为C9H8O4 | |
| B. | 1mol咖啡酸最多能与4mol氢气发生加成反应 | |
| C. | 遇溴水,既能发生取代反应又能发生加成反应 | |
| D. | 能还原酸性KMnO4溶液,说明其分子中含有碳碳双键 |
18.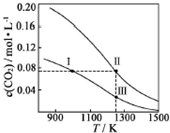 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 化学平衡常数K:K(状态Ⅰ)<K(状态Ⅱ)<K(状态Ⅲ) | |
| B. | CO2的平衡转化率α:α(状态Ⅰ)<α(状态Ⅱ)=α(状态Ⅲ) | |
| C. | 体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
5.下列物质对应的化学式错误的是( )
| A. | 偏铝酸钡 Ba(AlO2)2 | B. | 明矾 KAl(SO4)2•12H2O | ||
| C. | 醋酸钙 (CH3COO)2Ca | D. | 亚硫酸氢钙 CaHSO3 |
3.下列有关MnO2的叙述正确的是( )
| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下: