题目内容
3.常温下,下列叙述正确的是( )| A. | 1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 1.0×10ˉ8mol•L-1盐酸的pH=8.0 | |
| D. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
分析 A.据c(氢离子)×V(HCl)=c(氢氧根离子)×V(NaOH)求出氢氧根离子浓度,在求算pH;
B.根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
C.盐酸的pH不可能大于7;
D.醋酸稀释过程中酸性减弱.
解答 解:A.因酸碱混合后pH=7,即恰好完全反应,设碱的浓度为c,则1×0.1mol/L=100×c,c=0.001mol/L,则NaOH溶液的pH=11,故A正确;
B.在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定小于7,故B错误;
C.因常温下,中性溶液的pH=7,则酸的pH一定小于7,即盐酸溶液的pH不会为8,故C错误;
D.因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故D错误;
故选A.
点评 本题考查溶液pH的有关计算、盐的水解原理,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及计算方法,C为易错点,注意常温下酸溶液的pH不可能大于7.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.如图各情况,在其中Fe片腐蚀由快到慢的顺序是( )
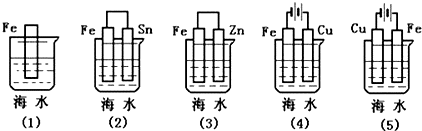

| A. | (5)(2)(1)(3)(4) | B. | (5)(2)(3)(1)(4) | C. | (4)(2)(1)(3)(5) | D. | (4)(2)(1)(5)(3) |
11.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )
| A. | Mg、Ag | B. | Fe、Mg | C. | Al、Zn | D. | Mg、Al |
18.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 澄清石灰水与过量苏打溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 碘化亚铁中通入氯气:2I-+Cl2═I2+2Cl- |
8.下列有关叙述正确的是( )
| A. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 | |
| C. | 田间焚烧秸秆易造成灰霾,灰霾粒子平均直径在1000~2000nm之间,能发生丁达尔效应 | |
| D. | 汽车尾气净化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 |
15.下列四位同学设计的实验方案能达到实验目的是( )
| A. | 甲同学为测定0.01mol•L-1盐酸的pH值:用湿的玻璃棒蘸取盐酸,点在pH试纸上 | |
| B. | 乙同学要检验(NH4)2Fe(SO4)2•12H2O晶体中的NH4+:取少量晶体溶于水,加入足量浓NaOH溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| C. | 丙同学为检验Fe3O4中+2价铁元素:先用稀盐酸溶解Fe3O4,再滴加KMnO4溶液 | |
| D. | 丁同学要验证FeCl3与KI反应的限度:可将少量的FeCl3溶液与过量的KI溶液混合,充分反应后用CCl4萃取,静置,再滴加KSCN溶液 |
12.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)═MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
13.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
| A. | 可能呈酸性 | B. | 可能呈中性 | C. | 一定呈碱性 | D. | 一定呈中性 |
 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液