题目内容
17.下列说法正确的是( )| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
分析 原电池是将化学能转化为电能的装置,原电池工作时正极上发生还原反应,负极发生氧化反应;电解池与原电池相反应,是电能转化为化学能的装置,阴极发生还原反应,阳极发生氧化反应,据此解答.
解答 解:A.原电池是将化学能转化为电能的装置,故A错误;
B.原电池活泼金属作负极,失电子发生氧化反应,故B正确;
C.电解池是将是电能转化为化学能的装置,故C错误;
D.电解池中阳极失电子发生氧化反应,故D错误;
故选B.
点评 本题考查学生原电池、电解池的工作原理和能量转化知识,属于教材知识的考查,较简单.

练习册系列答案
相关题目
7.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 39g K 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 含4 molHCl的浓盐酸和足量MnO2加热反应可生成NA个Cl2分子 | |
| C. | 标准状况下,22.4L 氟化氢中含2NA个原子 | |
| D. | 2mol单质Cu与足量高温硫蒸气完全反应,失去2NA个电子 |
8.A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大.已知:
(1)常温下,某气态单质甲分子与AB分子互为等电子体,则一个甲分子中包含2个π键.
(2)关于B的氢化物,中心原子的杂化类型是sp3,分子的空间构型V形,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是水分子间存在氢键.
(3)D元素原子核外有13种运动状态不同的电子.当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(4)E元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.E晶体中微粒的堆积方式是面心立方最密堆积
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ•mol-1)为:I1=738I2=1451I3=7732I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
(2)关于B的氢化物,中心原子的杂化类型是sp3,分子的空间构型V形,其熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是水分子间存在氢键.
(3)D元素原子核外有13种运动状态不同的电子.当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(4)E元素基态原子的价电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.E晶体中微粒的堆积方式是面心立方最密堆积
5.下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
| A. | 空气、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、CH3CH2OH | D. | H2SO4、盐酸 |
12.下列关于苯的结构和性质说法,正确的是( )
| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
2.短周期主族元素 X、Y、Z、W、Q 的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z 的单质能溶于 W 的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
9.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理中不正确的是( )
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸用玻璃棒引流慢慢注入水中 | |
| C. | 浓硫酸有腐蚀性,沾到皮肤上,应用较多的水冲洗,再涂上碳酸氢钠稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |

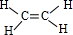
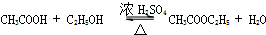 .
.