题目内容
6.一混合溶液,可能含有下列离子:Na+、Ba2+、Cl-、NO3-、SO42-、CO32-.①取少量此溶液,加入稀盐酸振荡,有气体生成;再加入硝酸银溶液,振荡可观察到白色沉淀生成;
②另取少量此溶液加入BaCl2溶液,产生白色沉淀,加入稀盐酸沉淀部分溶解.
(1)则此混合溶液中肯定存在的离子有Na+、CO32-、SO42-;肯定不存在的离子有Ba2+,不能确定的离子有Cl-、NO3-.
(2)②中主要涉及的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl,BaCl2+Na2SO4=BaSO4↓+2NaCl,BaCO3+2HCl=BaCl2+2H2O+CO2↑.
(3)①中,加入硝酸银溶液观察到白色沉淀生成,不能说明原溶液中含有Cl-.(填“能”或者“不能”)
(4)洗涤沉淀的方法为向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次.
分析 ①取少量溶液,加入用稀盐酸,有气体产生,说明含CO32-,溶液中就不能有Ba2+,再加入硝酸银溶液,振荡可观察到白色沉淀生成,不能证明溶液中有氯离子,前面的实验中加入了盐酸,引入了氯离子;
②另取少量此溶液加入BaCl2溶液,产生白色沉淀可能是硫酸钡、碳酸钡,加入稀盐酸沉淀部分溶解,说明溶液中含有CO32-、SO42-;
溶液必须呈电中性,所以一定有阳离子Na+,不能确定是否有Cl-、NO3-.
解答 解:①取少量溶液,加入用稀盐酸,有气体产生,说明含CO32-,溶液中就不能有Ba2+,再加入硝酸银溶液,振荡可观察到白色沉淀生成,不能证明溶液中有氯离子,前面的实验中加入了盐酸,引入了氯离子;
②另取少量此溶液加入BaCl2溶液,产生白色沉淀可能是硫酸钡、碳酸钡,加入稀盐酸沉淀部分溶解,说明溶液中含有CO32-、SO42-;
溶液必须呈电中性,所以一定有阳离子Na+,不能确定是否有Cl-、NO3-.
(1)由分析可知:混合溶液中肯定存在的离子有Na+、CO32-、SO42-,肯定不存在的离子有Ba2+,不能确定的离子有Cl-、NO3-,
故答案为:Na+、CO32-、SO42-;Ba2+;Cl-、NO3-;
(2)先是钡离子与碳酸根、硫酸根反应生成碳酸钡、硫酸钡沉淀,碳酸钡溶于盐酸生成氯化钡、二氧化碳和水,反应方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,BaCl2+Na2SO4=BaSO4↓+2NaCl,BaCO3+2HCl=BaCl2+2H2O+CO2↑,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;BaCl2+Na2SO4=BaSO4↓+2NaCl;BaCO3+2HCl=BaCl2+2H2O+CO2↑;
(3)①中加入硝酸银溶液,振荡可观察到白色沉淀生成,不能证明溶液中有氯离子,因为前面的实验中加入了盐酸,引入了氯离子,
故答案为:不能;
(4)洗涤沉淀方法:向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次,
故答案为:向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次.
点评 本题考查离子的推断,为高频考点,把握离子之间的反应为解答的关键,侧重分析、推断能力的综合考查,题目难度不大.

| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
| A. | 阴极呈无色,阳极呈红色 | B. | 正极呈红色,负极呈无色 | ||
| C. | 阳极呈无色,阴极呈红色 | D. | 负极呈红色,正极呈无色 |
 ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒. 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
.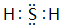 .
.