题目内容
4.下列有关热化学方程式的叙述正确的是( )| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ | |
| B. | 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol | |
| D. | 己知C(s)+O2 (g)=CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.根据能量越低越稳定判断;
C.依据中和热的概念即稀的强酸与强碱反应生成1mol水所放出的热量来计算写出热化学方程式;
D.①C(s)+O2 (g)=CO2(g);△H1
②2C(s)+O2(g)=2CO(g);△H2
根据盖斯定律②-①得到C(s)+CO2(g)=2CO(g);△H2-△H1,据此分析.
解答 解:A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,热化学方程式中水是气体不是稳定氧化物,则氢气的燃烧热大于241.8kJ/mol,故A错误;
B.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷能量高,所以红磷稳定,故B错误;
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol,故C正确;
D.已知①C(s)+O2 (g)=CO2(g);△H1
②2C(s)+O2(g)=2CO(g);△H2
根据盖斯定律②-①得到C(s)+CO2(g)=2CO(g);△H2-△H1,因为C(s)+CO2(g)=2CO(g)为吸热反应△H>0,则△H1<△H2,故D错误;
故选C.
点评 本题考查了热化学方程式的书写,燃烧热、中和热概念的分析应用,为高考常见题型和高频考点,侧重于学生的分析和计算能力的考查,注意把握相关概念的理解,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
15.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
SO2(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,其他条件不变,分离出硫,正反应速率加快 | |
| C. | 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 | |
| D. | 其他条件不变,使用不同催化剂,该反应平衡常数不变 |
12.在标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0.2mol NH3.下列对这四种气体的描述不正确的是( )
| A. | 体积 ②>③>①>④ | B. | 密度 ②>③>④>① | ||
| C. | 质量 ②>③>④>① | D. | 氢原子个数 ①>③>④>② |
19.某KNO3溶液中含杂质KCl和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
9.假如你是卫生防疫人员,为配制0.01mol•L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是( )
| A. | 称量时,左盘高,右盘低 | |
| B. | 定溶时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后未干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
13.对下列装置或操作描述正确的是( )
| A. | 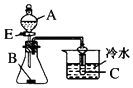 图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 | |
| B. | 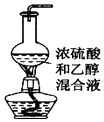 图用于实验室制乙烯 | |
| C. |  图用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| D. | 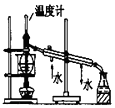 图用于实验室中分馏石油 |
14.设NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 2.0g重水(D2O)中含有的中子数为NA | |
| B. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| C. | 23g金属钠变为钠离子时失去的电子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
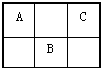 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. 、
、 .
.