题目内容
5.现有如下微粒:A.Fe3+B.S2- C.HCl.其中在反应中只能作还原剂的有B,只能作氧化剂的有A,既可作氧化剂又可作还原剂的有C.分析 由元素的化合价可知,处于最高价元素的离子只具有氧化性,处于最低价元素的离子只具有还原性,而处于中间价态元素的离子既有氧化性又有还原性,以此来解答.
解答 解:A.Fe3+为元素的最高价,则只具有氧化性;
B.S2-为元素的最低价,则只具有还原性;
C.HCl中H元素的化合价可降低,Cl元素的化合价可升高,既有氧化性又有还原性;
故答案为:B; A; C.
点评 本题考查氧化还原反应,侧重氧化剂、还原剂的考查,明确元素的化合价与元素的性质是解答的关键,题目难度不大.

练习册系列答案
相关题目
15.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
SO2(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,其他条件不变,分离出硫,正反应速率加快 | |
| C. | 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 | |
| D. | 其他条件不变,使用不同催化剂,该反应平衡常数不变 |
13.对下列装置或操作描述正确的是( )
| A. | 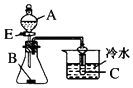 图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 | |
| B. | 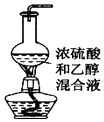 图用于实验室制乙烯 | |
| C. |  图用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| D. | 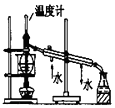 图用于实验室中分馏石油 |
20.下列装置及相应操作能达到实验目的是( )
| A. | 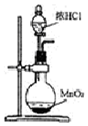 用如图装置制取氯气 | |
| B. | 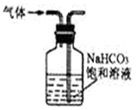 用如图装置除去CO2中的少量SO2气体 | |
| C. | 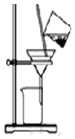 用如图装置分离饱和Na2CO3溶液中的NaHCO3晶体 | |
| D. | 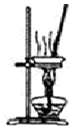 用如图装置将MgCl2.6H2O加热得到MgCl2 |
10.下列说法不正确的是( )
| A. | 复分解反应一定不是氧化还原反应 | B. | 置换反应一定是氧化还原反应 | ||
| C. | 化合反应一定是氧化还原反应 | D. | 分解反应不一定是氧化还原反应 |
17.在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(s)+2Y(g)?2Z(g),能判断该反应达平衡状态的是( )
| A. | 容器内气体压强不随时间变化 | |
| B. | 容器内气体密度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | X的消耗速率和Z的生成速率之比为1:2 |
14.设NA为阿伏加德罗常数,下列说法不正确的是( )
| A. | 2.0g重水(D2O)中含有的中子数为NA | |
| B. | 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA | |
| C. | 23g金属钠变为钠离子时失去的电子数为NA | |
| D. | 常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
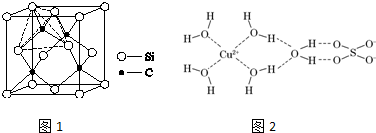
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.