题目内容
16.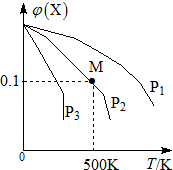 某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )
某可逆反应为2X(g)?3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示,下列推断正确的是( )| A. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ | |
| B. | 压强大小有P3>P2>P1 | |
| C. | 平衡后加入高效催化剂使气体相对分子质量增大 | |
| D. | 升高温度,该反应平衡常数K减小 |
分析 A.2X(g)?3Y(g)+Z(g)
开始 a 0 0
转化 2x 3x x
平衡 a-2x 3x x
M点X的物质的量分数为0.1,则$\frac{a-2x}{a-2x+3x+x}$=0.1,解得x=$\frac{9}{22}$a;
B.由图及平衡移动可知,压强越大,X的物质的量分数越大;
C.催化剂不影响平衡移动;
D.由图可知,温度越高,X的物质的量分数越小,则升高温度,平衡正向移动.
解答 解:A.2X(g)?3Y(g)+Z(g)
开始 a 0 0
转化 2x 3x x
平衡 a-2x 3x x
M点X的物质的量分数为0.1,则$\frac{a-2x}{a-2x+3x+x}$=0.1,解得x=$\frac{9}{22}$a,则在该条件下M点X平衡转化率为$\frac{2×\frac{9}{22}a}{a}$=$\frac{9}{11}$,故A正确;
B.由图及平衡移动可知,压强越大,X的物质的量分数越大,则压强大小有P3<P2<P1,故B错误;
C.催化剂不影响平衡移动,则平衡后加入高效催化剂,气体相对分子质量不变,故C错误;
D.由图可知,温度越高,X的物质的量分数越小,则升高温度,平衡正向移动,则升高温度,该反应平衡常数K增大,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握平衡影响因素、化学平衡三段法为解答的关键,侧重分析与计算能力的考查,注意图象分析,题目难度不大.

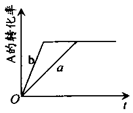 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(2)Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-?Ag2S(s)+2Cl-,沉淀转化的主要原因是Ag2S比AgCl溶解度更小.
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y.
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是SO42-.
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀S.
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化.
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
②C中盛放的物质W是Ag2S的悬浊液.
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S+1O2++4NaCl+2H2O?4AgCl+2S+4NaOH.
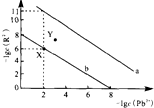 25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )| A. | 曲线a表示PbCO3 | |
| B. | 以PbSO4、Na2CO3和焦炭为原料可制备Pb | |
| C. | 当PbSO4和PbCO3沉淀共存时,溶液中$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=105 | |
| D. | 向X点对应的饱和溶液中加入少量Pb(NO3)2,可转化为Y点对应的溶液 |
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10min至20min时间内平均速率v(A)为0.013mol/(L•min);达到平衡时A的转化率是50%,B的浓度是0.25mol/L;800℃时,该反应2A(g)?B(g)+D(g) 的平衡常数数值是0.25;若同温下,另一个恒容密闭的容器中也在发生该反应,某时刻A、B、D的浓度均为2mol/L,则该时刻v(正)<v(逆)(填“>”“=”或“<”).
(2)在实验2中,A的初始浓度c1=1.0mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是使用了催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1(填“>”“=”或“<”),且c2> 1.0mol/L (填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应是放热反应(填“吸热”或“放热”).

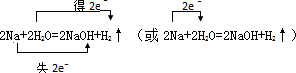 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.