题目内容
下列离子方程式书写正确的是( )
| A、钠和水反应:2Na+2H2O═2Na++2OH-+H2↑ |
| B、FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
| C、铜和浓HNO3反应:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
| D、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.钠与水反应生成氢氧化钠和氢气;
B.电荷不守恒;
C.原子个数不守恒;
D.离子个数不符合物质的配比.
B.电荷不守恒;
C.原子个数不守恒;
D.离子个数不符合物质的配比.
解答:
解:A.钠和水反应,离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.FeCl3溶液腐蚀铜线路板,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.铜和浓HNO3反应,离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故C错误;
D.NaHSO4溶液与Ba(OH)2溶液反应至中性,离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误;
故选:A.
B.FeCl3溶液腐蚀铜线路板,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.铜和浓HNO3反应,离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故C错误;
D.NaHSO4溶液与Ba(OH)2溶液反应至中性,离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误;
故选:A.
点评:本题考查了离子方程式的书写,题目难度不大,熟悉反应的实质是解题关键,注意离子方程式应遵循电荷守恒、原子个数守恒.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化合物中既存在离子键,又存在配位键的是( )
| A、H2O |
| B、NH4Cl |
| C、NaOH |
| D、Na2O2 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如下图为N2(g)相 O2(g)反应生成NO(g)过程中的能量变化:下列说法正确的是( )


| A、1mol N2(g)和1molO2(g)具有的总能量大于 2mol NO(g)具有的总能量 |
| B、1molN2(g)和lmolO2(g)反应生成2molNO(g)吸收180 kJ热量 |
| C、通常情况下N2(g)和O2(g)混合能直接反应生成NO |
| D、数据不足,不能确定反应热的大小 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、铁发生氧化还原反应,一定失去NA个电子 |
| B、18gD2O含有的质子数为10NA |
| C、常温常压下,46gNO2和N2O4的混合物中含有的原子数为3NA |
| D、1mol/LNa2CO3溶液中含有的Na+数目为2NA |
下列说法正确的是( )
| A、不能跟碱反应的氧化物一定能和酸反应 |
| B、溶液和胶体的本质区别在于分散质粒子的直径大小不同 |
| C、58.5gNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为l mol?L-1 |
| D、将SO2通入滴有酚酞的NaOH溶液中,溶液红色消失,说明SO2具有漂白性 |
 如图所示装置中,甲、乙、丙三个烧杯依次盛有NaOH溶液、CuSO4溶液和Na2SO4溶液,电极均为石墨电极,接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次盛有NaOH溶液、CuSO4溶液和Na2SO4溶液,电极均为石墨电极,接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答问题:
 苯胺易被氧化)
苯胺易被氧化)
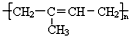 )为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为
)为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为