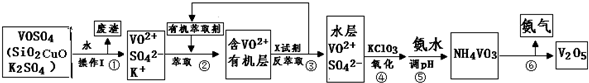
题目内容
已知化学式为C4H10O的醇有4种异构体,若在该分子中增加1个羰基,形成的C5H10O2的羧酸可能有的结构有( )
| A、2种 | B、4种 | C、6种 | D、5种 |
考点:同分异构现象和同分异构体
专题:同分异构体的类型及其判定
分析:根据化学式为C4H10O的醇有4种异构体,若在该分子中增加1个羰基,形成的C5H10O2的羧酸相当于在醇中氢氧键上插入羰基,即羧酸的种类等于醇的种类.
解答:
解:化学式为C4H10O的醇有4种异构体,若在该分子中增加1个羰基,形成的C5H10O2的羧酸相当于在醇中氢氧键上插入羰基,即羧酸的种类等于醇的种类,即4种,故选B.
点评:本题考查同分异构体的书写,难度中等,注意根据结构利用换元法进行解答.

练习册系列答案
相关题目
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A、加入适量NaCl溶液 |
| B、加入适量NaOH溶液 |
| C、加入数滴CuCl2溶液 |
| D、加入适量NaNO3溶液 |
下列有关试剂的保存方法错误的是( )
| A、浓硝酸保存在棕色玻璃试剂瓶中 |
| B、少量的金属锂保存在煤油中 |
| C、氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 |
| D、少量液溴通常保存在棕色玻璃试剂瓶中,并在液溴上加少量水液封 |
用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫质量物质的量浓度,其单位为mol/Kg,若5mol/Kg的硫酸溶液的密度为1.49g/mL,则该H2SO4物质的量浓度为( )
| A、3.56mol/L |
| B、4.36mol/L |
| C、5.00mol/L |
| D、5.25mol/L |
下列对电离平衡常数K的叙述中,不正确的是( )
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数.则下列说法正确的是( )
| A、简单离子半径大小顺序:r(T)<r(X)<r(Y) |
| B、T与Z的最高正化合价相等 |
| C、室温下,单质Y不能与浓硫酸反应 |
| D、可用电解法制得X、Y、Z的单质 |
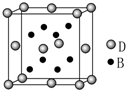 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.