题目内容
19.①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质.请回答下列问题.(1)上述4种物质中属于盐的是③ (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是①.
(2)写出HCl的电离方程式HCl═H++Cl-.
(3)写出过氧化钠与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为HCO3-+H+═H2O+CO2↑.
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式SiO2+2NaOH═Na2SiO3+H2O.
分析 (1)由金属阳离子(或铵根离子)和酸根离子组成的化合物属于盐;酸使紫色石蕊溶液变红;
(2)盐酸是强酸,完全电离产生氢离子和氯离子;
(3)过氧化钠和水反应生成氢氧化钠和氧气;
(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,根据离子方程式的书写方法书写;
(5)二氧化硅与氢氧化钠反应生成硅酸钠和水,据此写出反应的方程式.
解答 解:(1)①盐酸属于酸、②铁是单质、③碳酸氢钠是盐、④二氧化硅是氧化物;①盐酸是酸,能使紫色石蕊溶液变红,故答案为:③;①;
(2)盐酸是强酸,完全电离产生氢离子和氯离子,方程式为:HCl=H++Cl-,故答案为:HCl=H++Cl-;
(3)过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,碳酸氢钠与胃酸中的盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑;
(5)二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的化学方程式为:SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O.
点评 本题主要考查了物质的性质和物质的分类,涉及方程式的书写,难度不大,要注重审题过程.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列物质中,属于芳香烃且属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列物质中,溶于水且能发生电离的是( )
| A. | 硫酸钡 | B. | Cu | C. | NaCl | D. | 蔗糖 |
4.下列解释实验事实的方程式正确的是( )
| A. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O═2Fe(OH)3 | |
| D. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
9.下列各组物质中,能用高锰酸钾酸性溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 1-己烯、甲苯 | C. | 苯、正己烷 | D. | 丙烷 丙炔 |
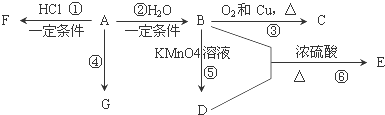
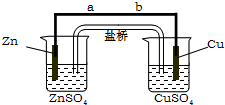 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题: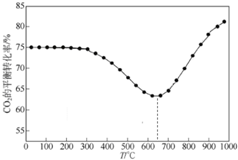 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.