题目内容
4.下列解释实验事实的方程式正确的是( )| A. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O═2Fe(OH)3 | |
| D. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
分析 A.氢氧化钠与氧化铝反应生成偏铝酸钠和水;
B.不符合反应客观事实;
C.得失电子不守恒;
D.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主.
解答 解:A.用氢氧化钠溶液去除铝条表面的氧化膜,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故A正确;
B.铜片溶于稀硝酸产生无色气体一氧化氮,离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B错误;
C.氢氧化亚铁在空气中变质,离子方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故C错误;
D.碳酸钠溶液呈碱性,离子方程式:CO32-+H2O?HCO3-+OH-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意两性物质的性质及盐类水解规律,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
9.亚硫酸盐是一种常见的食品添加剂.用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量).
[样品]$→_{①}^{稀H_{2}SO_{4}边通N_{2}边煮沸}$[气体A]$→_{②}^{H_{2}O_{2}溶液}$[含H2SO4]$→_{③}^{NaOH溶液}$[中和液],下列说法不正确的是( )
[样品]$→_{①}^{稀H_{2}SO_{4}边通N_{2}边煮沸}$[气体A]$→_{②}^{H_{2}O_{2}溶液}$[含H2SO4]$→_{③}^{NaOH溶液}$[中和液],下列说法不正确的是( )
| A. | 亚硫酸盐作为食品添加剂作用是防腐保鲜 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
16.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 泥浆 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
13.葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-).
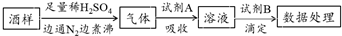
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性 | |
| B. | 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出 | |
| C. | 若试剂A选择氯水,则试剂B可选择NaOH标准液 | |
| D. | 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液 |
14.为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 | 实 验 结 论 |
| (1)将9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g. | (1)A的实验式为CH2O. |
| (2)通过质谱法测得其相对分子质量为90. | (2)A的分子式为C3H6O3. |
| (3)另取9.0g A,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)A中含有的官能团名称为羧基、羟基. |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2:2:1:1. | (4)综上所述,A的结构简式为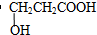 . .(5)写出A与NaHCO3反应的化学方程式 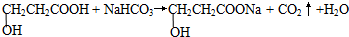 . . |
 H、C、N、O、Al、S是常见的六种元素.
H、C、N、O、Al、S是常见的六种元素.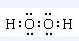 或H:C??C:H.
或H:C??C:H. $→_{一定条件}^{CO、HCl}$
$→_{一定条件}^{CO、HCl}$ ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: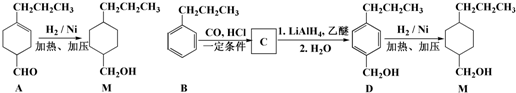
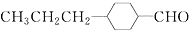 和
和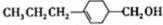 (写结构简式)生成.
(写结构简式)生成.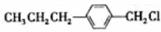 .
.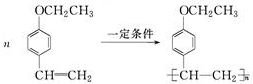 .
.