题目内容
11. CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.(1)举一例说明CO2在自然界碳循环过程中的作用光合作用.
(2)CO2加氢合成低碳烯烃技术在环境保护等方面具有重要意义.以合成C2H4为例,该转化分为两步进行:
第一步:CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
第二步:2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
①第一步反应的平衡常数表达式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
②CO2加氢合成乙烯的热化学方程式是2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol.
③一定条件下的密闭容器中,总反应达到平衡,要提高CO2的转化率,可以采取的措施是bd(选填字母).
a.低压b.增大H2浓度c.加入适当催化剂d.分离出水
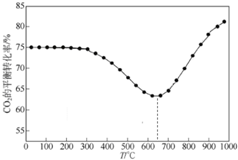
④如图是其他条件一定时,反应温度对CO2平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定).在温度高于约650℃时,CO2的平衡转化率随着温度升高而增大的原因是大于650℃时,第一步反应(吸热)为主,因此升温使CO2转化率增大.
分析 (1)二氧化碳参与光合作用,可以实现CO2在自然界碳循环;
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g);
③要提高CO2的转化率,改变条件应使平衡正向移动,但不能只增大二氧化碳的用量,否则转化率为降低,结合平衡移动原理分析解答;
④大于650℃时,第一步反应(吸热)为主,因此升温使CO2转化率增大.
解答 解:(1)二氧化碳参与光合作用,可以实现CO2在自然界碳循环,
故答案为:光合作用;
(2)①CO2(g)+H2(g)?CO(g)+H2O(g)的化学平衡常数表达式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案为:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
②已知:Ⅰ.CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ/mol
Ⅱ.2CO(g)+4H2(g)?C2H4(g)+2H2O(g)△H=-210.5kJ/mol
根据盖斯定律,Ⅰ×2+Ⅱ可得:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol,
故答案为:2CO2+6H2(g)=C2H4(g)+4H2O(g)△H=-127.9 kJ/mol;
③a.正反应为气体体积减小的反应,低压有利于逆向减小,CO2的转化率减小,故a错误;
b.增大H2浓度,平衡正向移动,CO2的转化率增大,故b正确;
c.加入适当催化剂,可以加快反应速率,但不影响平衡移动,CO2的转化率不变,故c错误;
d.分离出水,生成物浓度减小,平衡正向移动,CO2的转化率增大,故d正确,
故选:bd;
④大于650℃时,第一步反应(吸热)为主,正反应为吸热反应,升高温度平衡正向移动,因此升温使CO2转化率增大,
故答案为:大于650℃时,第一步反应(吸热)为主,因此升温使CO2转化率增大.
点评 本题考查化学平衡影响因素、平衡常数、盖斯定律应用等,注意对基础知识的理解掌握.

| A. | NaCl溶液 | B. | 盐酸 | C. | 硫酸 | D. | KSCN溶液 |
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
| A. | 泥浆 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
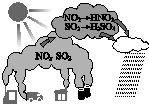
| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是CO32-+H2O?HCO3-+OH-.
②NaHCO3溶液也由无色变为红色,其原因是HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,水解程度大于电离程度.
③比较两份溶液的颜色,红色较浅的是NaHCO3(填化学式).
(2)研究NaHCO3与CaCl2的反应.
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
②实验2中形成的分散系属于胶体.
③用离子方程式表示实验2中发生的反应Ca2++2HCO3-=CaCO3↓+CO2+H2O.
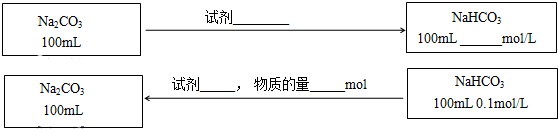
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略).
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.